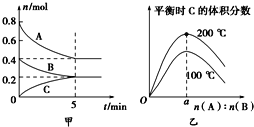
题目内容
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子。
(1)基态的F3+核外电子排布式是____________________________________________。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是______________。
(3)化合物FD3是棕色固体、易潮解、100 ℃左右时升华,它的晶体类型是______________;化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是____________________。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是______________________________________________________________。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的![]() (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为________。

【答案】1s22s22p63s23p63d5 NH3与H2O分子间存在氢键 分子晶体 ![]() K2Fe(SCN)5 4
K2Fe(SCN)5 4
【解析】
A、C的最外层电子数都是其电子层数的2倍,因为原子序数依次增大,即A为C,C为S,B的电负性大于C,且五种元素为不同主族的元素,即B为N,透过蓝色钴玻璃观察E的焰色反应为紫色,即E为K,则D为Cl,F的基态原子有4个未成对电子,外围电子排布为3d64s2,推出F为Fe,据此分析;
A、C的最外层电子数都是其电子层数的2倍,因为原子序数依次增大,即A为C,C为S,B的电负性大于C,且五种元素为不同主族的元素,即B为N,透过蓝色钴玻璃观察E的焰色反应为紫色,即E为K,则D为Cl,F的基态原子有4个未成对电子,外围电子排布为3d64s2,推出F为Fe,
(1)Fe元素位于第四周期Ⅷ族,26号元素,即Fe3+核外电子排布式为1s22s22p63s23p63d5;
答案为1s22s22p63s23p63d5;
(2)B的气态氢化物为NH3,A的气态氢化物是烃,C的气态氢化物是H2S,NH3与H2O能形成分子间氢键,增大NH3的溶解度,而烃和H2S不能与H2O形成分子间氢键;
答案为NH3与H2O分子间存在氢键;
(3)FD3为FeCl3,性质为100℃左右时升华,这是分子晶体的特点,即FeCl3为分子晶体;化合物ECAB是KSCN的阴离子是SCN-,AC2的化学式为CS2,CS2的结构式为S=C=S,SCN-与CS2互为等电子体,则SCN-的电子式为![]() ;
;
答案为分子晶体;![]() ;
;
(4)FeCl3与KSCN得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式为K2Fe(SCN)5;
答案为K2Fe(SCN)5;
(5)该晶胞的![]() 中含有Fe2+:4×
中含有Fe2+:4×![]() =
=![]() ,含Fe3+:4×
,含Fe3+:4×![]() =
=![]() ,含CN-:12×
,含CN-:12×![]() =3,根据化合价代数和为0,该
=3,根据化合价代数和为0,该![]() 的晶胞中含有K+:3-(
的晶胞中含有K+:3-(![]() ×2+3×
×2+3×![]() )=
)=![]() ,则一个晶胞中K+个数为
,则一个晶胞中K+个数为![]() ×8=4;
×8=4;
答案为4。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
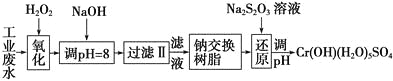
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2B.HNO3C.FeCl3D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水:
的废水:
该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O![]() 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5mol·L-1。
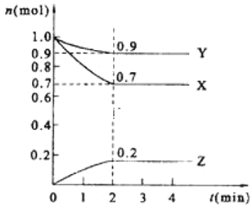
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
2min末浓度/mol/L | 0.08 | a | b |
平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20% B. t℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 D. 前2min内,用Y的变化最表示的平均反应速率v(Y)=0.03mol/(L·min)