题目内容
【题目】(1)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,ACl2的摩尔质量是__________________,A的相对原子质量是______________。
(2)1.5mol CO2中含_____ mol碳原子,________个氧原子(以NA为阿伏加德罗常数的值),标准状况下的体积为___________L。
① 实验室利用石灰石制备CO2______________________________________________
② SO2和足量NaOH反应 __________________________________________________
③写一个置换反应方程式 ______________________________________________
【答案】95 24 1.5 3NA 33.6 ![]()
![]() 符合条件即可
符合条件即可
【解析】
(1)根据M= ![]() 计算出ACl2的摩尔质量,根据ACl2式量计算出A的相对原子量;
计算出ACl2的摩尔质量,根据ACl2式量计算出A的相对原子量;
(2)根据n= ![]() =
= ![]() 进行计算;
进行计算;
(3)实验室利用石灰石制备CO2是碳酸钙与盐酸反应制备二氧化碳,据此写出方程式;
(4)SO2和足量NaOH反应生成亚硫酸钠与水,据此写出反应的方程式;
(5)单质与化合物反应生成另外一种单质和化合物,满足此条件的即可。
(1)因某二价金属的氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为![]() =0.2mol,则M(ACl2)=
=0.2mol,则M(ACl2)=![]() =95g/mol,则A的相对原子量为:95-35.5×2=24
=95g/mol,则A的相对原子量为:95-35.5×2=24
故答案为:95 gmol-1 ;24;
(2)1.5mol CO2中含1.5×1mol=1.5mol碳原子,1.5mol×2=3molO原子,故氧原子个数为3NA,标准状况下二氧化碳体积V=1.5mol×22.4L/mol=33.6L;
故答案为 1.5 ;3NA;33.6;
(3)实验室利用石灰石制备CO2是碳酸钙与盐酸反应制备二氧化碳,故方程式为![]() ;
;
故答案为![]() ;
;
(4)SO2和足量NaOH反应生成亚硫酸钠与水,反应方程式为![]() ;
;
故答案为![]() 。
。
(5)无条件的置换反应,符合题意即可,比如铁与硫酸铜溶液反应生成硫酸亚铁和铜,方程式为;Fe+CuSO4=FeSO4+Cu;
故答案是:无条件的置换反应,符合题意即可,比如Fe+CuSO4=FeSO4+Cu。

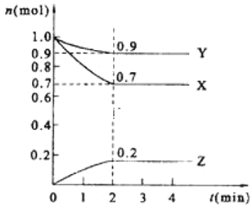
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
2min末浓度/mol/L | 0.08 | a | b |
平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20% B. t℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 D. 前2min内,用Y的变化最表示的平均反应速率v(Y)=0.03mol/(L·min)