题目内容
【题目】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥标明该反应中电子的转移及数目:___。
(2)还原剂是___;还原产物是___;被还原与未被还原N的个数比为___。
【答案】 Cu NO 1:3
Cu NO 1:3
【解析】
Cu与稀HNO3反应,Cu的化合价由0价变为+2价,化合价升高,作还原剂,生成的硝酸铜为氧化产物;硝酸中的N原子化合价降低,由+5价变为+2价,作氧化剂,生成还原产物,则反应的最小公倍数为6。
Cu与稀HNO3反应,Cu的化合价由0价变为+2价,化合价升高,作还原剂,生成的硝酸铜为氧化产物;硝酸中的N原子化合价降低,由+5价变为+2价,作氧化剂,生成还原产物,则反应的最小公倍数为6,双线桥法为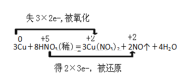 ;被还原的N原子的个数为2,未被还原N的个数为6,比值为1:3。
;被还原的N原子的个数为2,未被还原N的个数为6,比值为1:3。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目