题目内容
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______?
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
①NaOH溶液滴定CH3COOH溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.80×10-13,在此温度下,将pH=3的盐酸和
pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)mol/L。
(1)(10-5-10-9)mol/L(1分) bcf(1分)
(2)<(1分) =(1分)
(3)①图2 (1分) ②20.00(1分)
(4)c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)= c(OH-)(1分)
(5)2.05×10-11(1分)
解析试题分析:(1) pH =5的醋酸溶液中,氢离子的总的浓度为:10-5mol/L,但是由醋本身电离产生的氢离子浓度为总浓度与水所电离的氢离子浓度之差:(10-5-10-9)mol/L
(2) 等体积且pH均等于3的醋酸和盐酸溶液,醋酸所提供的氢离子的物质的量比盐酸的多。则生成氢气的体积:V(盐酸)<V(醋酸)。又因为二者的起始氢离子浓度,所以反应的最初速率为:v(盐酸=v(醋酸)。(3)浓度相等的盐酸和醋酸其PH值不等,可知NaOH溶液滴定CH3COOH溶液的曲线是图2。a点是刚好酸碱反应时的值,所以为20.00ml。(4)醋酸钠溶液显弱碱性,所以加入盐酸使其呈中性时的量就较小。因此有:
c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)= c(OH-)
(5) 将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,溶液显碱性,所以应该先求此时溶液中的氢氧根离子的浓度,(假设二者各自的体积为V)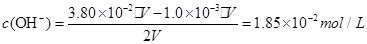
又因为在90℃时,水的离子积常数为Kw = 3.80×10-13,所以混合溶液中: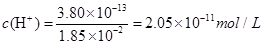
考点:电离平衡的知识。

 金钥匙试卷系列答案
金钥匙试卷系列答案已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示: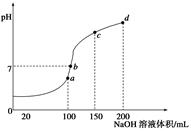
| | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
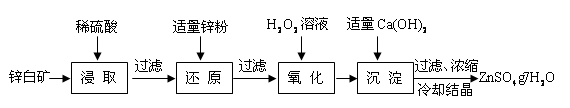
(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: 。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O
 CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。 人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。
 Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题: