题目内容
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示: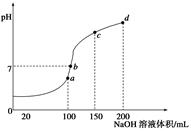
| | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
(1)铝 ;
(2)16 、2
(3)2H2S + O2 = 2H2O+2S↓
(4)小于
(5)①a; ②c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) ③NH4+ + OH-=NH3·H2O;
解析试题分析:(1)由于该元素的第一、第二、第三电离能相差不多,但第四电离能与第三电离能相差很多,说明该元素的原子最外层有三个电子。在组成的NH4Al(SO4)2的元素中只有Al符合题意。因此元素M的名称是铝。
(2)S是16号元素,所以硫原子核外有16种不同运动状态的电子,S的核外电子排布为1s22s22p63s23p4有s、p两种不同形状的电子云;
(3)证明氧气的氧化性比硫的氧化性强的事实是2H2S + O2 = 2H2O+2S↓。
(4)在相同条件下,等浓度的0.1 mol/L NH4Al(SO4)2和0.1 mol/LNH4HSO4中Al3+水解使溶液显酸性比酸电离出的H+酸性要小的多,它们都对(NH4+的水解起到抑制作用。由于后者酸性强,抑制作用大,故c(NH4+)前者小于后者。
(5)①a点对应的NaOH溶液与NH4HSO4的物质的量相等,发生反应NaOH+NH4HSO4= NH4NaSO4 +H2O。NH4++H2O NH3·H2O+H+.对水的电离起到了促进作用。b点时n(NaOH)>n(NH4HSO4)溶液的PH=7,溶液.对水的电离无影响。C点D点对应的NaOH溶液体积逐渐增大,碱越来越多对水的抑制作用越来越强。故水的电离程度最大的是a点。
NH3·H2O+H+.对水的电离起到了促进作用。b点时n(NaOH)>n(NH4HSO4)溶液的PH=7,溶液.对水的电离无影响。C点D点对应的NaOH溶液体积逐渐增大,碱越来越多对水的抑制作用越来越强。故水的电离程度最大的是a点。
②n(NaOH)>n(NH4HSO4)溶液的PH="7," 溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
③在c d段由于OH-过量,所以发生反应的离子方程式NH4+ + OH-=NH3·H2O。
考点:考查NH4Al(SO4)2的元素的原子结构、性质及与NaOH溶液混合发生反应的离子浓度、方程式等知识。

(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。
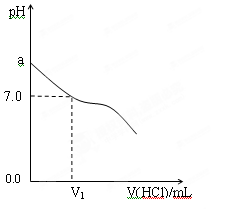
①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程 。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是 。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是 。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是 。
③乙同学这样配制混合溶液的理由是 。
 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。