题目内容
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。
(1)100 mL容量瓶、胶头滴管 稀H2SO4 偏小
(2)5H2C2O4+2MnO4—+6H+=10CO2↑+2Mn2++8H2O
(3)溶液由无色变为紫红色且半分钟内不褪色
(4)1.2
(5)小
解析

(16分)NH3在生活生产中用途广泛。
(1)下列关于NH3或氨水的实验能达到目的的是 (填编号)
| 编号 | A | B | C | D |
| 实验 装置 | 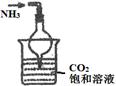 | 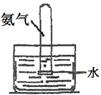 |  | 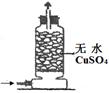 |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |

①N2和H2通过A装置,A装置的作用除了将气体混合外,还有 、 作用。
②实验结束,C中溶液有刺激性气味,C溶液中存在的含氮元素的微粒有 。
③某小组消耗大量的N2和H2,但得到的氨水浓度远低于其他组,可能的原因有 。(至少写出一项。注:实验试剂均未变质。)
(3)为验证氨水具有弱碱性,设计了下列实验,其中能达到实验目的是 。(填编号)
A.在氨水中滴入酚酞,溶液变红色
B.测定相同浓度的NaOH和氨水溶液的pH
C.将氨水和过量AlCl3溶液混合,产生白色沉淀
D.用pH试纸测定1mol/L NH4Cl溶液的酸碱性
(4)在实验室初步测定NH3?H2O的电离平衡常数。
①NH3?H2O电离平衡常数的表达式为:K= 。
②限选试剂和仪器:浓度为0.1mol/L 的氨水、0.1000mol/L 盐酸、1.000mol/L 盐酸、酚酞试剂、甲基橙试剂、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、pH计、烧杯等(省略夹持仪器)
| 实验步骤 | 实验目的 |
| 步骤1: ①用碱式滴定管取20.00ml 0.1mol/L 的氨水于锥形瓶中,加入几滴 。 ② 。 ③ ,停止滴定,记录数据。重复测定2-3次。 | 测定氨水的准确浓度。 |
| 步骤2: ; | ; |
| 步骤3:通过计算得出氨水的电离常数。 | |
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。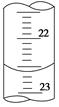
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
 H++H2PO3-。
H++H2PO3-。