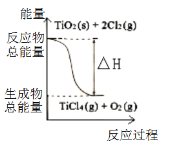
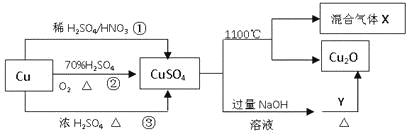
题目内容
【题目】下列离子方程式正确的是
A.溴化亚铁溶液中通少量的氯气:2Br-+ Cl2=== 2Cl-+ Br2
B.氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I- = 2Fe2++I2+6H2O
C.碳酸氢钙与少量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
【答案】B
【解析】
A.Fe2+还原性比Br-强,先发生反应,故A错误;
B.氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I- = 2Fe2++I2+6H2O,故B正确;
C.碳酸氢钙过量无碳酸根生成,反应为:![]() ,故C错误;
,故C错误;
D.Fe过量反应生成Fe2+,反应为:![]() ,故D错误;
,故D错误;
故答案选:B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
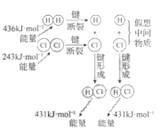
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D