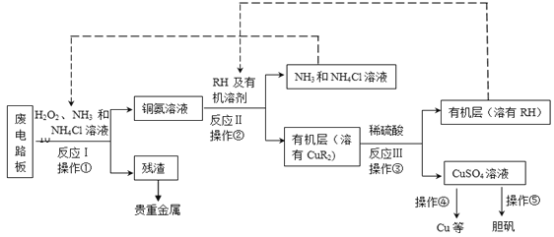
题目内容
【题目】某溶液X中可能含有下列离子中的若干种:NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-为了确定该溶液的组成,某同学取上述溶液X,进行了如下实验:
(1)向一定量溶液X加入少量氯水,然后滴加淀粉溶液,未显蓝色;
(2)另取100毫升溶液X再加入足量氯水,然后滴加足量BaCl2溶液,得到沉淀6.99g;
(3)将上述(2)的反应混合液过滤,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为2.24L。
根据上述实验,以下推测正确的是
A.原溶液可能存在Na +、Fe3+、SO42-
B.原溶液一定存在NH4+、I-
C.原溶液一定不含Ba2+、Fe3+、I-
D.另取X试液滴加足量盐酸酸化的BaCl2溶液,即可确定溶液所有的离子组成
【答案】B
【解析】
由(2)可知溶液中必定存在SO32-或SO42-物质的量之和为![]() ,由(3)可知必定存在NH4+,物质的量为
,由(3)可知必定存在NH4+,物质的量为![]() ,结合溶液中电荷守恒和离子共存分析。
,结合溶液中电荷守恒和离子共存分析。
由(2)可知溶液中必定存在SO32-或SO42-物质的量之和为![]() ,由(3)可知必定存在NH4+,物质的量为
,由(3)可知必定存在NH4+,物质的量为![]() ,根据电荷守恒可知溶液中必定存在至少0.04molI-,由(1)可知溶液中存在SO32-;Fe3+与I-不共存,必定不存在;Ba2+与SO32-不共存,必定不存在,Na+和SO42-可能存在,
,根据电荷守恒可知溶液中必定存在至少0.04molI-,由(1)可知溶液中存在SO32-;Fe3+与I-不共存,必定不存在;Ba2+与SO32-不共存,必定不存在,Na+和SO42-可能存在,
A.原溶液可能存在Na +、SO42-,Fe3+必定不存在,故A错误;
B. 原溶液一定存在NH4+、I-,故B正确;
C. 原溶液一定不含Ba2+、Fe3+,I-一定存在。故C错误;
D. 另取X试液滴加足量盐酸酸化的BaCl2溶液,只能确定验证 SO42-的存在,无法确定Na +是否存在,故D错误;
故答案选:B。

【题目】某工厂废液经测定得知主要含有乙醇,其中还含有丙酮、乙酸和乙酯乙酯。根据下表中各物质的性质,按下列步骤回收乙醇和乙酸。
已知:乙酸乙酯在碱性条件下水解生成乙酸钠和乙醇。
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 77.06 | 78.5 | 117.9 |
①向废液中加入烧碱溶液,调整溶液的pH=10;②将混合液放入蒸馏器中缓缓加热;③收集温度在70~85℃时的馏出物;④排出蒸馏器中的残液,冷却后向其中加浓硫酸(过量),然后再放入耐蒸馏器中进行蒸馏,回收馏出物。请回答下列问题:
(1)加入烧碱使溶液的pH=10的目的是_______________________。
(2)在70~85℃时馏出物的主要成分是________。
(3)在步骤④中加入过量浓硫酸的目的是(用化学方程式表示)_____________________。