题目内容
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2 (s) + 2Cl2 (g) =TiCl4 (g)+O2 (g) ΔH 1 = +175.4 kJ·mol-1
②C(s) + 1/2O2 (g) = CO (g) ΔH 2 =-110.45 kJ·mol-1
下列说法正确的是
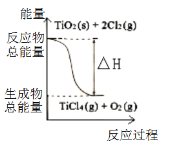
A.反应①中的能量变化如右图所示
B.若反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,则ΔH 1变小
C.固体C的燃烧热是-110.45 kJ·mol-1
D.反应TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) ΔH =-45.5 kJ·mol-1
【答案】D
【解析】
A.反应①的焓变为正,为吸热反应;
B.催化剂可不改变反应的始终态;
C.C的燃烧热中生成稳定氧化物为二氧化碳;
D.由盖斯定律可知,①+②×2得到![]() 。
。
A. 反应①的焓变为正,为吸热反应,而图中为放热反应,故A错误;
B. 催化剂可不改变反应的始终态,则反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,但△H1不变,故B错误;
C. C的燃烧热中生成稳定氧化物为二氧化碳,由反应②不能确定C的燃烧热,故C错误;
D. 由盖斯定律可知,①+②×2得到![]()
![]() 故D正确;
故D正确;
故答案选:D。

练习册系列答案
相关题目