题目内容
【题目】用0.1000mol/L NaOH溶液滴定分别滴定0.1000mol/L的盐酸和醋酸溶液各25.00 mL。滴定过程中溶液pH随滴入的NaOH溶液体积变化的两条滴定曲线如图所示:
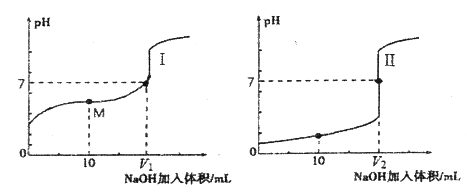
(1)滴定醋酸的曲线是_____________(填“Ⅰ”或“Ⅱ”)。
(2)下列方法中可使溶液中醋酸的电离程度减小的是_____________(填字母序号)。
A. 微热溶液 B. 加少量冰醋酸
C. 加少量醋酸钠固体 D. 加少量碳酸钠固体
(3)V1和V2的关系:V1________V2(填“>”、“=”或“<”)。
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_____________。
【答案】I BC < c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】
(1)醋酸为弱酸,则0.1000mol/L的醋酸溶液pH应大于1,所以滴定醋酸的曲线是I;
(2)A. 电离吸热,微热溶液会促进醋酸的电离,故A错误;
B. 加少量的冰醋酸,醋酸的浓度增大,浓度越大电离程度越小,故B正确;
C. 醋酸钠固体可以电离出醋酸根离子,抑制醋酸的电离,故C正确;
D. 加入碳酸钠固体,碳酸根消耗氢离子,使醋酸的电离平衡右移,促进醋酸的电离,故D错误;
综上所述选BC;
(3)CH3COONa是强碱弱酸盐其水溶液呈碱性,要使混合溶液呈中性,则CH3COOH应该稍微过量,NaCl是强酸强碱盐,其水溶液呈中性,酸碱的物质的量相等,所以V1<V2;
(4)M点混合溶液中溶质为等物质的量浓度的CH3COONa、CH3COOH,pH小于7,溶液呈酸性,则c(H+)>c(OH-),CH3COOH电离程度大于CH3COONa水解程度,结合电荷守恒得c(CH3COO-)>c(Na+),溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案