题目内容
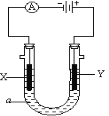
【题目】由O2、NO2 和熔融NaNO3组成的燃料电池如图所示,在该电 池工作过程中石墨I电极产生一种气态氧化物Y。下列说法正确的是
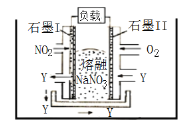
A.电子由负载流向石墨I
B.Y可能为NO
C.石墨I上发生还原反应
D.石墨II上的电极反应: O2 + 2N2O5 + 4e- = 4NO3-
【答案】D
【解析】
由图可知,石墨I上NO2发生氧化反应,为负极,电极反应:![]() ,石墨II上O2发生还原反应,为正极,电极反应为:
,石墨II上O2发生还原反应,为正极,电极反应为:![]() ,以此分析。
,以此分析。
由图可知,石墨I上NO2发生氧化反应,为负极,电极反应:![]() ,石墨II上O2发生还原反应,为正极,电极反应为:
,石墨II上O2发生还原反应,为正极,电极反应为:![]() ,
,
A. 电子负极石墨I经负载流向正极石墨II,故A错误;
B.NO中N化合价为+2价,石墨I NO2中N化合价为+4价,此时石墨I上发生还原反应,不符合,故B错误;
C. 石墨I上发生氧化反应,故C错误;
D. 石墨II上的电极反应: ![]() ,故D正确;
,故D正确;
故答案选:D。

练习册系列答案
相关题目
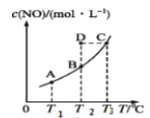
【题目】N2O5在一定温度下可发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是( )
A.500s内NO2的生成速率为2.96×10-3mol/(L·s)
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.平衡后,其他条件不变,将容器体积变为原来的![]() ,则c(N2O5)<5.00mol/L
,则c(N2O5)<5.00mol/L
D.T1、T2温度下的平衡常数分别为K1、K2,若T1>T2,则K1>K2