题目内容
中学化学中几种常见物质的转化关系如下:
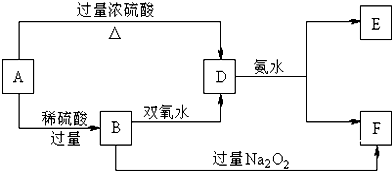
已知A→D的反应必须加热,否则会发生钝化现象.请回答下列问题:
(1)B、D、E的化学式依次为 、 、 .
(2)写出B的酸性溶液与双氧水反应的离子方程式: .
(3)写出A和过量浓硫酸加热反应生成D的化学方程式 .

已知A→D的反应必须加热,否则会发生钝化现象.请回答下列问题:
(1)B、D、E的化学式依次为
(2)写出B的酸性溶液与双氧水反应的离子方程式:
(3)写出A和过量浓硫酸加热反应生成D的化学方程式
考点:无机物的推断
专题:推断题
分析:A→D的反应必须加热,否则会发生钝化现象,能和浓硫酸发生钝化现象的是Al或Fe,B能和双氧水或过氧化钠反应,说明A是变价金属,则A为Fe、B为FeSO4、D为Fe2(SO4)3,D和氨水反应生成氢氧化铁和硫酸铵,B被过氧化钠氧化生成氢氧化铁,则F是Fe(OH)3、E为(NH4)2SO4,据此解答.
解答:
解:A→D的反应必须加热,否则会发生钝化现象,能和浓硫酸发生钝化现象的是Al或Fe,B能和双氧水或过氧化钠反应,说明A是变价金属,则A为Fe、B为FeSO4、D为Fe2(SO4)3,D和氨水反应生成氢氧化铁和硫酸铵,B被过氧化钠氧化生成氢氧化铁,则F是Fe(OH)3、E为(NH4)2SO4,
(1)通过以上分析知,B、D、E分别是FeSO4、Fe2(SO4)3、(NH4)2SO4,
故答案为:FeSO4;Fe2(SO4)3;(NH4)2SO4;
(2)B为硫酸亚铁,酸性条件下,硫酸亚铁不稳定,被双氧水氧化生成硫酸铁,自身被还原生成水,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)Fe和过量浓硫酸加热反应生成硫酸铁、二氧化硫与水,反应的化学方程式为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O.
(1)通过以上分析知,B、D、E分别是FeSO4、Fe2(SO4)3、(NH4)2SO4,
故答案为:FeSO4;Fe2(SO4)3;(NH4)2SO4;
(2)B为硫酸亚铁,酸性条件下,硫酸亚铁不稳定,被双氧水氧化生成硫酸铁,自身被还原生成水,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)Fe和过量浓硫酸加热反应生成硫酸铁、二氧化硫与水,反应的化学方程式为:2Fe+6H2SO4(浓)
| ||
故答案为:2Fe+6H2SO4(浓)
| ||
点评:本题以铁及其化合物为载体考查了无机物推断,“A→D的反应必须加热,否则会发生钝化现象”是推断突破口,注意亚铁离子的不稳定性及双氧水和过氧化钠的强氧化性,B与过氧化氢、过氧化钠的反应为易错点.

练习册系列答案
相关题目
碳酸氢铵(NH4HCO3)是一种氮肥,其属于( )
| A、氧化物 | B、酸 | C、碱 | D、盐 |
标准状况下,2mol Cl2和2mol H2O相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |