题目内容
(1)下表是不同温度下水的离子积数据:
若25<t1<t2,则a 1×10-14(填“>”、“<”或“=”);
t2℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol?L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)= .
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),△H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是 .
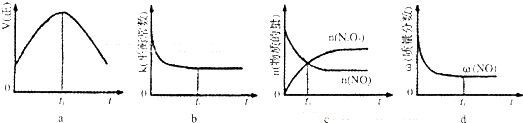
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
t2℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol?L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),△H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是
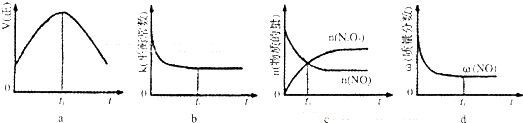
考点:水的电离,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)水是弱电解质,存在电离平衡,电离吸热;
根据硫酸钠溶液是显中性进行计算;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
根据硫酸钠溶液是显中性进行计算;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答:
解:(1)水是弱电解质,存在电离平衡,电离吸热,所以温度升高,水的电离程度增大,离子积增大,故a>1×10-14;
t2℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-6=100:1,
故答案为:>;100:1;
(2)a.平衡时,正逆反应速率应相等,且保持不变,故a错误;
b.平衡时,化学平衡常数应保持不变,故b正确;
c.平衡时,各物质的物质的量应保持不变,故c错误;
d.平衡时,NO的百分含量保持不变,故d正确,
故答案为:bd.
t2℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-6=100:1,
故答案为:>;100:1;
(2)a.平衡时,正逆反应速率应相等,且保持不变,故a错误;
b.平衡时,化学平衡常数应保持不变,故b正确;
c.平衡时,各物质的物质的量应保持不变,故c错误;
d.平衡时,NO的百分含量保持不变,故d正确,
故答案为:bd.
点评:本题考查考查水的电离、水的离子积常数的有关计算、平衡状态的判断,难度中等.注意水的离子积常数与温度有关.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
一定量的镁铝合金与500mL 1mol?L-1 HNO3完全反应生成2.24LNO(标况),再向反应后的溶液中加入2mol?L-1 NaOH溶液,使镁、铝元素完全沉淀,则所加NaOH溶液体积是( )
| A、50mL | B、100mL |
| C、150mL | D、200mL |
能用H++OH-=H2O来表示的化学反应是( )
| A、Cu(OH)2和H2SO4溶液反应 |
| B、KOH溶液和醋酸溶液反应 |
| C、澄清石灰水和HNO3溶液反应 |
| D、Ba(OH)2溶液和H2SO4溶液反应 |
常温下,在密闭固定体积容器里分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的
.则原混合气体可能是( )
| 3 |
| 4 |
| A、CO和O2 |
| B、HCl和NH3 |
| C、H2和Cl2 |
| D、H2和O2 |
 某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下: