题目内容
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,溴主要以Br-形式存在于海水中,海水呈弱碱性.回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,该过程的离子方程式为 ,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 .
(2)需要使用溴时,用硫酸酸化得到的Br-和BrO3-的混合物,而不用盐酸酸化混合物的原因可能是 .
(3)Cl2通入冷的石灰乳,用于制漂白粉,反应的化学方程式为 .
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 .
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液.
(1)海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,该过程的离子方程式为
(2)需要使用溴时,用硫酸酸化得到的Br-和BrO3-的混合物,而不用盐酸酸化混合物的原因可能是
(3)Cl2通入冷的石灰乳,用于制漂白粉,反应的化学方程式为
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液.
考点:海水资源及其综合利用
专题:卤族元素
分析:(1)氯气具有氧化性,能氧化溴离子生成单质溴;用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,结合质量守恒书写反应的离子方程式;
(2)BrO3-具有强氧化性,可氧化Cl-;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(4)注意除杂时不能引入新杂质,更不能影响被提纯物质.
(2)BrO3-具有强氧化性,可氧化Cl-;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(4)注意除杂时不能引入新杂质,更不能影响被提纯物质.
解答:
解:(1)氯气具有氧化性,能氧化溴离子生成单质溴,反应的离子方程式为2Br-+Cl2═2Cl-+Br2,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,反应的离子方程式为3 Br2+6 CO32-+3H2O═5Br-+BrO3-+6HCO3-(或3Br2+3CO32-═5Br-+BrO3-+3CO2),
故答案为:2Br-+Cl2═2Cl-+Br2;3 Br2+6 CO32-+3H2O═5Br-+BrO3-+6HCO3-(或3Br2+3CO32-═5Br-+BrO3-+3CO2);
(2)BrO3-具有强氧化性,可氧化Cl-,应避免引入新杂质,
故答案为:防止在酸性条件下,溴酸钠将Cl-氧化为氯气,影响生成溴的纯度;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+H2O;
(4)氯气和HBr反应生成溴,而加入bcd引入新杂质,且bd都与溴反应,只有HBr符合,故答案为:a.
故答案为:2Br-+Cl2═2Cl-+Br2;3 Br2+6 CO32-+3H2O═5Br-+BrO3-+6HCO3-(或3Br2+3CO32-═5Br-+BrO3-+3CO2);
(2)BrO3-具有强氧化性,可氧化Cl-,应避免引入新杂质,
故答案为:防止在酸性条件下,溴酸钠将Cl-氧化为氯气,影响生成溴的纯度;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+H2O;
(4)氯气和HBr反应生成溴,而加入bcd引入新杂质,且bd都与溴反应,只有HBr符合,故答案为:a.
点评:本题考查海水资源的综合利用,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,为解答该题的关键,难度不大.

练习册系列答案
相关题目
常温下,在密闭固定体积容器里分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的
.则原混合气体可能是( )
| 3 |
| 4 |
| A、CO和O2 |
| B、HCl和NH3 |
| C、H2和Cl2 |
| D、H2和O2 |
下列有关胶体的叙述不正确的是( )
| A、胶体粒子直径在1-100nm之间 |
| B、氢氧化铁胶体属于纯净物 |
| C、净水剂在水中形成的分散系是胶体 |
| D、光束通过胶体时有丁达尔效应 |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A、1mol/L氢氰酸溶液能电离出H+ |
| B、HCN易溶于水 |
| C、10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 |
| D、在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
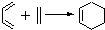 .
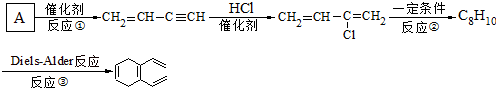
.
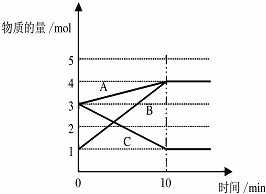 (1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
(1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.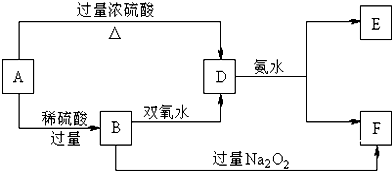
 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: