题目内容
针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2→H2O+O2
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是 ,H2O2仅体现还原性的反应是 ,H2O2既体现氧化性,又体现还原性的反应是 ,H2O2既不作氧化剂又不作还原剂的反应是 .(填代号)
(2)配平方程式D并标出反应中电子转移的方向和数目:
H2O2+Cr2(SO4)3+KOH═K2CrO4+K2SO4+H2O .
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2→H2O+O2
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是
(2)配平方程式D并标出反应中电子转移的方向和数目:
H2O2+Cr2(SO4)3+KOH═K2CrO4+K2SO4+H2O
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)H2O2仅体现氧化性,则O元素的化合价降低;双氧水仅体现还原性,说明双氧水在反应中仅被氧化,化合价只升高;H2O2既体现氧化性又体现还原性,则O元素的化合价既升高又降低;H2O2既不做氧化剂又不做还原剂,说明在反应中双氧水的化合价不发生变化;
(2)根据氧化还原反应化合价升降相等进行配平,利用转移的电子及方向表示.
(2)根据氧化还原反应化合价升降相等进行配平,利用转移的电子及方向表示.
解答:
解:(1)A.Na2O2+HCl→H2O2+NaCl,是一个非氧化还原反应,双氧水既不是氧化剂,也不是还原剂;
B.Ag2O+H2O2→Ag+O2+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中氧元素转化为O2;
C.H2O2→H2O+O2,过氧化氢的分解反应,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性;
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O,双氧水在反应中化合价由-1变成-2,化合价降低被还原,双氧水仅做氧化剂;
所以H2O2仅体现氧化性的反应是D;H2O2仅体现还原性的反应是B;H2O2既体现氧化性,又体现还原性的反应是C;H2O2既不做氧化剂又不做还原剂的反应是A,
故答案为:D;B;C;A;
(2)Cr2(SO4)3中Cr的化合价为+3价,反应后变成了K2CrO4,化合价变成+6,Cr元素化合价升高被氧化,化合价升高了3价,一分子Cr2(SO4)3参与反应,化合价至少升高6价;H2O2中氧元素化合价为-1价,反应后变成了-2价的O,化合价降低了1价,1分子双氧水反应,至少化合价降低2价,化合价变化的最小公倍数为6,所以Cr2(SO4)3的计量数为1,双氧水的计量数为3,然后利用观察法配平其它物质,配平后的方程式为3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,该反应中转移6e-,Cr失去电子,O得到电子,则电子转移方向和数目为 ,
,
故答案为: .
.
B.Ag2O+H2O2→Ag+O2+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中氧元素转化为O2;
C.H2O2→H2O+O2,过氧化氢的分解反应,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性;
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O,双氧水在反应中化合价由-1变成-2,化合价降低被还原,双氧水仅做氧化剂;
所以H2O2仅体现氧化性的反应是D;H2O2仅体现还原性的反应是B;H2O2既体现氧化性,又体现还原性的反应是C;H2O2既不做氧化剂又不做还原剂的反应是A,
故答案为:D;B;C;A;
(2)Cr2(SO4)3中Cr的化合价为+3价,反应后变成了K2CrO4,化合价变成+6,Cr元素化合价升高被氧化,化合价升高了3价,一分子Cr2(SO4)3参与反应,化合价至少升高6价;H2O2中氧元素化合价为-1价,反应后变成了-2价的O,化合价降低了1价,1分子双氧水反应,至少化合价降低2价,化合价变化的最小公倍数为6,所以Cr2(SO4)3的计量数为1,双氧水的计量数为3,然后利用观察法配平其它物质,配平后的方程式为3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,该反应中转移6e-,Cr失去电子,O得到电子,则电子转移方向和数目为
 ,
,故答案为:
 .
.
点评:本题考查了氧化还原反应,为高频考点,注意从元素化合价变化判断氧化性、还原性及氧化还原反应方程式的配平,题目难度中等,注意判断一个反应是否属于氧化还原反应,关键在于判断元素的化合价是否发生变化;H2O2中的氧元素化合价为-1,处于中间价态,它既可以升高又可以降低,即H2O2既有氧化性又有还原性.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
在酸性溶液中,可大量共存的离子是( )
| A、K+ Na+ OH- SO42- |
| B、Mg2+ SO42- NH4+ Cl- |
| C、K+ Na+ HCO3- Cl- |
| D、Ag+ Na+ NO3- Cl- |
下列有关胶体的叙述不正确的是( )
| A、胶体粒子直径在1-100nm之间 |
| B、氢氧化铁胶体属于纯净物 |
| C、净水剂在水中形成的分散系是胶体 |
| D、光束通过胶体时有丁达尔效应 |
“化学是人类进步的关键”.下列有关说法能反映正确化学观点的是( )
| A、改变物质的性质不一定要通过化学变化 |
| B、天然物质都比人造物质好 |
| C、一种元素可有多种离子,但只有一种原子 |
| D、根据分散系是否具有丁达尔效应,分散系分为溶液、胶体和浊液 |
下列说法不正确的是( )
| A、利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出 |
| B、固体药品取用:块状固体用镊子夹取,粉末状的用药匙或纸槽转移 |
| C、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、环形玻璃搅拌棒进行搅拌、酸和过量的碱充分反应、取2-3次的实验平均值,以达到良好的实验效果 |
| D、用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管未用同浓度盐酸润洗,将导致测定结果偏低 |
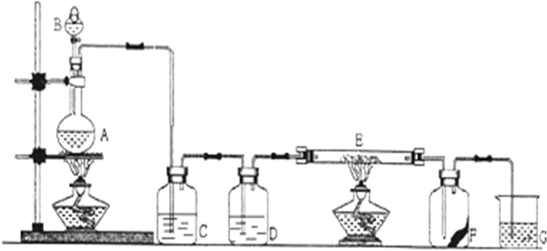
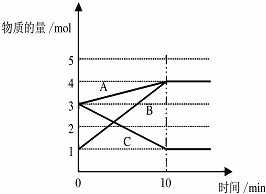 (1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
(1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.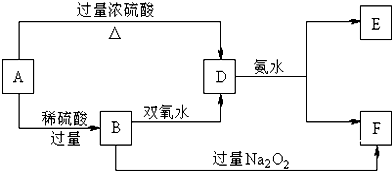
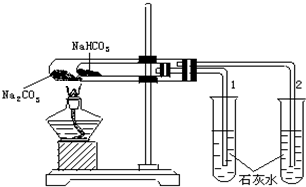 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: