题目内容
17.有一含0.04molH2SO4、0.04molHNO3的混合稀溶液,加入足量的铜粉,加热充分反应,最终可产生气体的物质的量是( )| A. | 0.01mol | B. | 0.03mol | C. | 0.04mol | D. | 0.01~0.03mol |
分析 先计算氢离子的物质的量,再根据溶液中发生的反应3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O判断过量,将不足的代入离子反应方程式来计算最终可产生气体的物质的量.
解答 解:混合液中含有硝酸根离子的物质的量为:n(NO3-)=0.04mol,
含有氢离子的物质的量为:n(H+)=0.04mol+0.04×2mol=0.12mol,
根据反应3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O可知,
铜足量,消耗0.04mol硝酸根离子完全反应消耗氢离子的物质的量为:0.04mol×$\frac{8}{2}$=0.16mol,显然H+不足,
设放出的气体的物质的量为x,则
3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O
8 2
0.12mol x
8x=0.12mol×2,
解得:x=0.03mol,
故选B.
点评 本题考查学生利用离子反应方程式进行的计算,题目难度中等,明确离子的物质的量及判断过量是解答本题的关键,并学会利用离子反应来分析解答问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号);
(2)表中元素⑩的原子结构示意图是 ;
;
(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填写化学式,下同);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4.
| 族 周期 | ⅠA | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 一 | ① | ||||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||||
| 四 | ⑪ | ⑫ | ⑬ | ||||||
(2)表中元素⑩的原子结构示意图是
 ;
;(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填写化学式,下同);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4.
8.综合如图判断,下列说法正确的是( )


| A. | 装置I和装置II中负极反应均是:Fe-2e-=Fe2+ | |
| B. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| C. | 装置I和装置II中Fe电极 的腐蚀速度为前者大于后者 | |
| D. | 放电过程中,装置I左侧烧杯和装置II右侧烧杯中溶液的PH均增大 |
5.下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素.
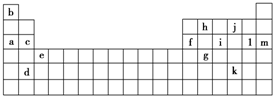
(1)上述第三周期元素中第一电离能(I1)最大的是m(用字母表示,下同),c和f的I1大小关系是c大于f.
(2)上述元素中,原子中未成对电子数最多的是i,写出该元素的电子排布式:1s22s22p63s23p3.
(3)根据下表所提供的电离能数据,回答下列问题.
①表中X可能为以上13种元素中的a元素.用元素符号表示X和j形成的化合物的化学式Na2O、Na2O2.
②Y是周期表中的ⅢA族的元素.

(1)上述第三周期元素中第一电离能(I1)最大的是m(用字母表示,下同),c和f的I1大小关系是c大于f.
(2)上述元素中,原子中未成对电子数最多的是i,写出该元素的电子排布式:1s22s22p63s23p3.
(3)根据下表所提供的电离能数据,回答下列问题.
| 锂 | X | Y | |
| I1 | 519 | 502 | 580 |
| I2 | 7296 | 4570 | 1820 |
| I3 | 11799 | 6920 | 2750 |
| I4 | 9550 | 11600 |
②Y是周期表中的ⅢA族的元素.
12.如表所列是元素周期表部分短周期的主族元素,已知R为地壳中含量最多的金属元素.
(1)写出Z的原子结构示意图 .
.
(2)W与氢原子形成6原子分子的结构简式CH2=CH2.
(3)超细RX粉末被应用于大规模集成电路领域.其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气.
已知①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ/mol.
(6)温度为T时,向2.0L恒容密闭容器中充入1.00mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡.反应过程中测定的部分数据见表:
相同温度下,起始时向容器中充入1.00mol PC15、0.20mol PCl3和0.40mol Cl2,反应达到平衡前v(正)<v(逆)(填“>”或“=”或“<”).
| W | X | Y | ||
| R | Z |
 .
.(2)W与氢原子形成6原子分子的结构简式CH2=CH2.
(3)超细RX粉末被应用于大规模集成电路领域.其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气.
已知①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ/mol.
(6)温度为T时,向2.0L恒容密闭容器中充入1.00mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡.反应过程中测定的部分数据见表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
2. 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片经过导线流向铜片 | |
| C. | 溶液中的阳离子向负极移动,阴离子向正极移动 | |
| D. | 当导线中有0.1mol电子通过时,铜片上产生气体1.12L(标准状况) |
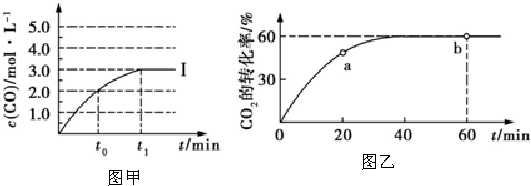
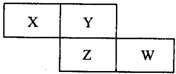 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图: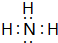 :业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3
:业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3 中和热的测定实验(如图).
中和热的测定实验(如图).