题目内容
13.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )| A. | Z为0.3 mol•L-1 | B. | X2为0.2 mol•L-1 | ||
| C. | Y2为0.4 mol•L-1 | D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,故A正确、BC错误;又反应前后物质的量不变,所以c(X2)+c(Y2)+c(Z)=0.6 mol•L-1,故D错误;
故选A.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
相关题目
4. 实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为ClO-+2I-+2H+═Cl-+I2+H2O.
②NaClO溶液的物质的量浓度是0.1060 mol•L -1.
 实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
②NaClO溶液的物质的量浓度是0.1060 mol•L -1.
1.把200mL含有CaCl2和KCl的混合溶液分成2等份,取一份加入含2a mol 碳酸钠的溶液,恰好使钙离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-4a) mol•L-1 | B. | 0.1(b-2a) mol•L-1 | C. | 10(b-4a) mol•L-1 | D. | 10(b-2a) mol•L-1 |
8.综合如图判断,下列说法正确的是( )


| A. | 装置I和装置II中负极反应均是:Fe-2e-=Fe2+ | |
| B. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| C. | 装置I和装置II中Fe电极 的腐蚀速度为前者大于后者 | |
| D. | 放电过程中,装置I左侧烧杯和装置II右侧烧杯中溶液的PH均增大 |
18.下列说法不正确的是( )
| A. | 废旧电池应集中回收处理 | |
| B. | 充电电池放电时,化学能转变为电能 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
5.下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素.
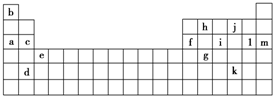
(1)上述第三周期元素中第一电离能(I1)最大的是m(用字母表示,下同),c和f的I1大小关系是c大于f.
(2)上述元素中,原子中未成对电子数最多的是i,写出该元素的电子排布式:1s22s22p63s23p3.
(3)根据下表所提供的电离能数据,回答下列问题.
①表中X可能为以上13种元素中的a元素.用元素符号表示X和j形成的化合物的化学式Na2O、Na2O2.
②Y是周期表中的ⅢA族的元素.

(1)上述第三周期元素中第一电离能(I1)最大的是m(用字母表示,下同),c和f的I1大小关系是c大于f.
(2)上述元素中,原子中未成对电子数最多的是i,写出该元素的电子排布式:1s22s22p63s23p3.
(3)根据下表所提供的电离能数据,回答下列问题.
| 锂 | X | Y | |
| I1 | 519 | 502 | 580 |
| I2 | 7296 | 4570 | 1820 |
| I3 | 11799 | 6920 | 2750 |
| I4 | 9550 | 11600 |
②Y是周期表中的ⅢA族的元素.
2. 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片经过导线流向铜片 | |
| C. | 溶液中的阳离子向负极移动,阴离子向正极移动 | |
| D. | 当导线中有0.1mol电子通过时,铜片上产生气体1.12L(标准状况) |
