题目内容
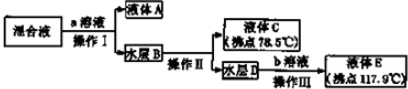
18.食盐是日常生活的必需品,也是重要的化工原料.(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如图1:
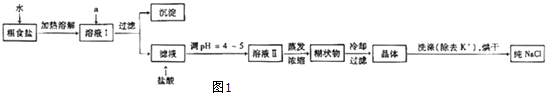
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液Ba(NO3)2溶液、75%乙醇、四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为BaCl2、NaOH、Na2CO3(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为75%乙醇
(2)用提纯的NaCl配制500mL 4.00mol•L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有天平、烧杯、500mL容量瓶、胶头滴管 (填仪器名称).
△
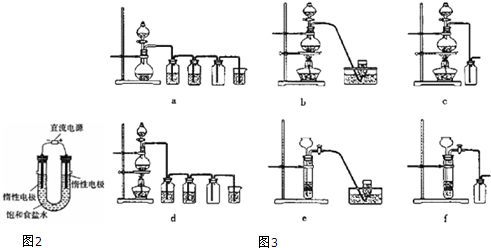
(3)电解饱和食盐水的装置如图2所示,若收集的H2为2L,则同样条件下收集的Cl2< (填“>”、“=”或“<”)2L,原因是电解生成的氯气与电解生成的NaOH发生了反应.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是中和滴定.
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4═ZnSO4+H2↑; MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置e(填图3代号)和制备并收集干燥、纯净Cl2的装置d(填代号).可选用制备气体的装置:-.
分析 (1)①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,可以分别采用碳酸钠、氢氧化钠、氢氧化钠和氯化钡,根据试剂的添加原则来回答;
②根据有机物的性质以及氯化钾在有机物中的溶解度知识来回答;
(2)配制一定物质的量浓度的溶液,所需的仪器有:药匙、玻璃棒、天平、烧杯、500mL容量瓶、胶头滴管;
(3)根据电解饱和食盐水时的产物以及氯气和氢氧化钠的反应以及中和滴定实验原理知识来回答;
(4)实验室中采用金属锌和酸反应来获得氢气,利用二氧化锰和浓盐酸加热来获得氯气.
解答 解:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-,Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+,
故答案为:BaCl2、NaOH、Na2CO3;
②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(2)配制一定物质的量浓度的溶液,所需的仪器有:药匙、玻璃棒、天平、烧杯、500mL容量瓶、胶头滴管,
故答案为:天平、烧杯、500mL容量瓶、胶头滴管;
(3)电解饱和食盐水的反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L,若测定溶液中NaOH的浓度,常用中和滴定的方法,
故答案为:<;电解生成的氯气与电解生成的NaOH发生了反应;中和滴定;
(4)实验室中采用金属锌和酸不加热反应来获得氢气,故选择装置e,利用二氧化锰和浓盐酸加热来获得氯气,其中的杂质氯化氢可以加饱和食盐水来除,杂质水可以采用浓硫酸来除去,可以选择装置d,
故答案为:e;d.
点评 本题主要考查了在粗盐提纯、配制一定物质的量浓度的溶液方法及常见气体的制备方法,题目难度中等,注意掌握粗盐提纯方法,明确除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去.

| A. | 原子序数:a>b>c | B. | 离子半径:Yn->Zm- | ||
| C. | a-b=m-n | D. | 原子核外最外层电子数:X>Y>Z |
| A. | 液氨可用作制冷剂 | |
| B. | 硅酸钠用于制备硅胶和木材防火剂的原料 | |
| C. | 用热的纯碱溶液洗涤油污 | |
| D. | 明矾可用于自来水的杀菌消毒 |
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 30 | 1mL蒸馏水 |
(2)经过5分钟反应,实验①中草酸完全消耗,则草酸的平均反应速率为0.025mol/(L•min).
(3)反应生成的CO2可以用来合成甲醇(CH3OH):CO2(g)+3H2(g)═CH3OH(g)+H2O(g),
该反应是放热反应.断裂1mol CO2中的化学键消耗能量Q1kJ,断裂1mol H2中的化学键消耗能量Q2kJ,形成1mol CH3OH中的化学键释放能量Q3kJ,形成1mol H2O中的化学键释放能量Q4kJ,则该条件下,生成1mol CH3OH放出的能量为(3Q3+Q4-3Q2-Q1)kJ (用Q1、Q2、Q3、Q4的计算式表示).
(4)在一定条件下,密闭容器中进行的反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
达到化学平衡状态,下列说法正确的是B(填序号).
A.各物质的浓度相等
B.消耗3mol H2的同时消耗1mol CH3OH
C.反应达到平衡时,升高温度反应速率不变.
| A. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- | |
| B. | 0.1mol.L-1AgNO3溶液:H+、K+、SO42-、Cl- | |
| C. | 强酸性溶液:Mg2+、K+、SO42-、NO3- | |
| D. | 0.1mol.L-1NaAlO2溶液:NH4+、Na+、OH-、CO32- |
| A. | AgCl难溶于水,悬浊液中不会溶有Ag+和Cl- | |
| B. | AgCl沉淀生成和AgCl沉淀溶解不断进行,但速率相等 | |
| C. | 在AgCl的悬浊液中加入AgCl固体,溶解的AgCl会增多 | |
| D. | 在AgCl的悬浊液中加入NaCl固体,AgCl沉淀的溶解度增大 |
 .
.
 乙酸是白醋中的主要成分.
乙酸是白醋中的主要成分.