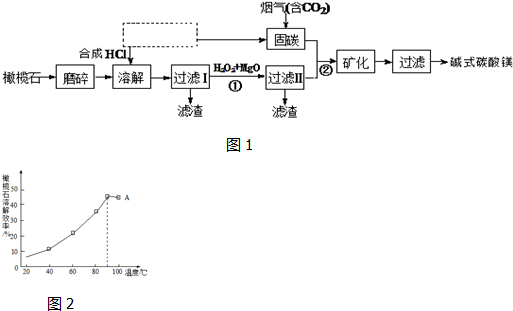
题目内容
7.已知aXm+、bYn-、cZm-(m>n)三中离子具有相同的电子层结构,下列关系正确的是( )| A. | 原子序数:a>b>c | B. | 离子半径:Yn->Zm- | ||
| C. | a-b=m-n | D. | 原子核外最外层电子数:X>Y>Z |
分析 三种离子aXm+、bYn-、cZm-(m>n),它们具有相同的电子层结构,则a-m=b+n=c+m,由于m>n,故原子序数大小顺序是a>b>c,结合离子所得电荷可知,X为金属元素,Y、Z为非金属元素,二者同周期,且X位于Y、Z的下一周期,电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:三种离子aXm+、bYn-、cZm-(m>n),它们具有相同的电子层结构,则a-m=b+n=c+m,由于m>n,故原子序数大小顺序是a>b>c,结合离子所得电荷可知,X为金属元素,Y、Z为非金属元素,二者同周期,且X位于Y、Z的下一周期.
A.三离子的电子层结构相同,则a-m=b-n=c+m,由于m>n,故原子序数大小顺序是a>b>c,故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:Yn-<Zm-,故B错误;
C.由电子层结构相同,则a-m=b+n,故a-b=m+n,故C错误;
D.非金属原子最外层电子数较大,同周期随原子序数增大,最外层电子数增多,故原子核外最外层电子数:X<Z<Y,故D错误,
故选A.
点评 本题考查原子结构与元素周期律,确定元素在周期表中的相对位置是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.25℃时将等体积盐酸和氨水混合,若混合溶液中[NH4+]=[Cl-],则溶液的pH值( )
| A. | >7 | B. | <7 | C. | =7 | D. | 不能确定 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大,已知X、Y、Z+、W各微粒最外层电子数与其电子层数之比值依次为2、3、4、2,下列有关这四种元素叙述正确的是( )
| A. | Y与X、Z、W分别能形成两种化合物 | |
| B. | Z与W形成的Z2W型化合物在水溶液中Z+离子与W2-离子个数比为2:1 | |
| C. | Y、Z、W不可能形成水溶液呈碱性的化合物 | |
| D. | 化合物X Y2、X YW、X W2随着共价键的键长逐渐增大,熔沸点逐渐降低 |
15.某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
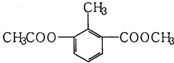

| A. | 一个分子中含有12个H原子 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 苯环上的一氯代物有2种 | |
| D. | 1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol |
2.取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
| A. | 甲烷与氯气在光照的作用下生成一氯甲烷的反应 | |
| B. | 乙烯与溴的四氯化碳溶液生成溴乙烷的反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 乙烯自身生成聚乙烯的反应 |
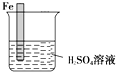 生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.
生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.