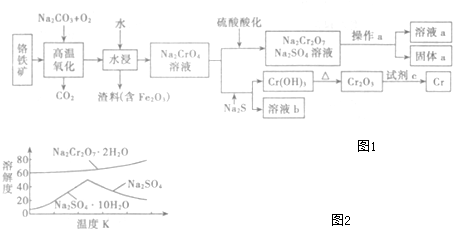
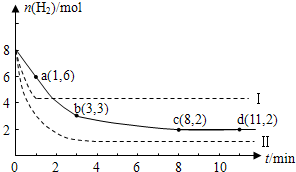
题目内容
12.已知三价铁离子的氧化性比铜离子强.现将a mol 铁和b mol铜的混合物与含有c mol HNO3的稀释溶液充分反应,设还原产物为NO.下列结论:①若剩余金属0.5a mol,则氧化产物为一种或二种;
②若只有二种氧化产物,被还原的硝酸物质的量为0.25c mol;
③若有三种氧化产物,被还原的硝酸物质的量为0.25c mol;
④若只有一种氧化产物,则3c=8a.
其中正确的组合是( )
| A. | ①② | B. | ③④ | C. | ①③ | D. | 只有② |
分析 还原性Fe>Cu,则稀硝酸不足时铁优先反应生成硝酸亚铁:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,若硝酸有剩余,则铜参与反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,若硝酸足量,则亚铁离子被氧化生成铁离子,发生总反应为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,据此对各选项进行判断.
解答 解:①若剩余金属0.5a mol,该金属可能为铁或铜,若为铁,则溶质为硝酸亚铁,若为铜,则氧化产物可能为硝酸亚铁和硝酸铜,故①正确;
②若只有二种氧化产物,氧化产物可能为硝酸亚铁和硝酸铜或硝酸铜和硝酸铁,硝酸可能过量,稀硝酸不一定完全反应,则无法计算被还原的硝酸的量,故②错误;
③若有三种氧化产物,氧化产物为硝酸铜、硝酸铁和硝酸亚铁,说明硝酸完全反应,根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,被还原的硝酸的物质的量为cmol×$\frac{1}{4}$=0.25cmol,故③正确;
④若只有一种氧化产物,说明铁过量,铜没有参与反应,反应后溶质为硝酸亚铁,但是amol铁不一定完全反应,无法确定a与c的关系,故④错误;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理及反应的先后顺序为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
2.aX(g)+bY(g)?cZ(g)+dW(g)在一定体积的密闭容器中反应5min达到平衡时,X减少n mol•L-1,Y减少$\frac{n}{3}$ mol•L-1,Z增加$\frac{2n}{3}$ mol•L-1.若将体系压强增大,W的百分含量不发生变化.则化学方程式中各物质的化学计量数之比a:b:c:d应为( )
| A. | 3:1:2:1 | B. | 1:3:2:2 | C. | 3:1:2:2 | D. | 1:3:1:2 |
3.下列有关电化学原理的说法中,错误的是( )
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 | |
| C. | 氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
20.某混合溶液中可能含有下列离子中的若干种:${NH}_{4}^{+}$、Al3+、Fe2+、Fe3+、${SO}_{4}^{2-}$、${NO}_{2}^{-}$、${NO}_{3}^{-}$、${CO}_{3}^{2-}$,现取三份20mL该溶液于锥形瓶,分别进行如下实验:
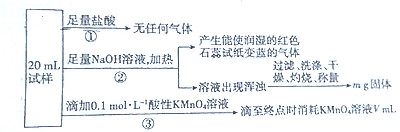
根据上述实验,以下说法不正确的是( )

根据上述实验,以下说法不正确的是( )
| A. | 由实验①可推断原混合溶液中一定不存在${NO}_{2}^{-}$、${CO}_{3}^{2-}$ | |
| B. | 由实验①③可推断原混合溶液中一定存在Fe2+,一定不存在${NO}_{3}^{-}$ | |
| C. | 原混合溶液中肯定存在${NH}_{4}^{+}$、Fe2+、${SO}_{4}^{2-}$ | |
| D. | 如果给出m、V的具体数据,可以确定Al3+、Fe3+是否存在 |
11.下列物质的用途错误的是( )
| A. | 晶体硅是制造太阳能电池的常用材料 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 氢氟酸可用刻蚀玻璃 | |
| D. | 硅是制取水泥的原料 |
 与HCN反应引入:
与HCN反应引入: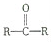 $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$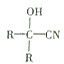
 $→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D
$→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D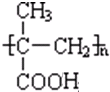 .
.