题目内容
15.某化学兴趣小组用如下装置模拟工业制备造纸原料BaSO3,并测定产品纯度.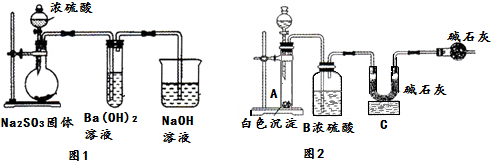
(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.
分析 (1)亚硫酸钠和浓硫酸反应生成二氧化硫气体、硫酸钠和水;
(2)可能二氧化硫被氧化为三氧化硫在溶液中形成硫酸,所以白色沉淀可能是硫酸钡;
(3)硫酸钡和亚硫酸钡都不溶于水,加入盐酸,亚硫酸钡沉淀可以溶解,硫酸钡不溶于盐酸;
(4)装置2是利用白色沉淀加入酸溶解生成的二氧化硫气体干燥后被碱石灰吸收来测定二氧化硫的质量,酸溶解亚硫酸钡沉淀,所以氢氧化钠不符合硝酸能氧化亚硫酸钡,干扰测定结果,只能选用稀盐酸;C装置增重为二氧化硫的质量,依据元素守恒计算亚硫酸钡的质量得到质量分数;实验中选用盐酸溶解沉淀会导致测定结果偏大;装置中生成的二氧化硫气体不能全部被碱石灰吸收会导致结果偏小;
(5)装置中残留的氧气使Na2SO3氧化生成Na2SO4,所以为制备纯净的BaSO3,可以将图1装置中烧瓶改用三孔塞,其中利用导气管通入不反应的气体如氮气,把装置中的空气全部赶到出.
解答 解:(1)亚硫酸钠和浓硫酸反应生成二氧化硫气体、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,
故答案为;Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)可能二氧化硫被氧化为三氧化硫在溶液中形成硫酸,所以白色沉淀可能是亚硫酸钡和硫酸钡.
故答案为:BaSO4;
(3)用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液,白色沉淀不溶解,溶液呈红色,说明硫酸钡和亚硫酸钡都不溶于水,加入盐酸,亚硫酸钡沉淀可以溶解,硫酸钡不溶于盐酸,沉淀部分溶解证明含有硫酸钡沉淀,
故答案为:稀盐酸;沉淀部分溶解;
(4)装置2是利用白色沉淀加入酸溶解生成的二氧化硫气体干燥后被碱石灰吸收来测定二氧化硫的质量,酸溶解亚硫酸钡沉淀,所以氢氧化钠不符合硝酸能氧化亚硫酸钡,干扰测定结果,只能选用稀盐酸,C装置增重为二氧化硫的质量,依据元素守恒计算亚硫酸钡的质量=$\frac{mg}{64g/mol}$×217g/mol,得到亚硫酸钡质量分数=$\frac{\frac{217m}{64}}{W}$×100%=$\frac{217m}{64w}$×100%;装置中生成的二氧化硫气体不能全部被碱石灰吸收会导致结果偏小,实验中选用盐酸溶解沉淀会导致测定结果偏大,
故答案为:稀盐酸; $\frac{217m}{64w}$×100%;SO2未被完全吸收;盐酸挥发出HCl被C中碱石灰吸收;
(5)装置中残留的氧气使Na2SO3氧化生成Na2SO4,所以为制备纯净的BaSO3,可以将图1装置中烧瓶改用三孔塞,其中利用导气管通入不反应的气体如氮气,把装置中的空气全部赶到出,以减小实验误差,
故答案为:装置中残留的氧气使Na2SO3氧化生成Na2SO4;从烧瓶左边通入氮气排除装置中的空气.
点评 本题考查了物质组成和性质的实验探究和验证,实验分析,现象判断,实验设计是解题关键,题目难度中等.

| A. | 氧化镁与稀硝酸反应:O2-+2H+═H2O | |
| B. | 向稀硫酸溶液中撒入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑ | |
| D. | 向氢氧化钠溶液中通入少量二氧化碳 2OH-+CO2=CO32-+H2O |
| A. | 向某溶液中,先加入氯水后滴入KSCN溶液,若溶液呈红色,则说明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取待测液放在火焰上灼烧,若火焰呈黄色,则说明待测液中含有钠离子,不含钾离子 | |
| C. | 分液时,分液漏斗中下层液体从下口放出后,将上层液体从上口倒入另一个洁净的烧杯中 | |
| D. | 蒸馏时,应将温度计的水银球插入蒸馏烧瓶内的混合液体中 |
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | CF4 CBr4 CsCl SiO2 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | SiO2 CsCl CBr4 CF4 |
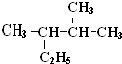 2,3-二甲基戊烷.
2,3-二甲基戊烷.
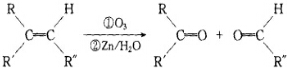
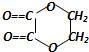 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.