题目内容
5.某河道两旁有甲乙两厂.它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是K+;Cl-;OH-. 乙厂的废水中含有另外三种离子.
对于该两厂的废水,可采取下列两种方法来处理:
(2)如果在废水中加一定量的铁粉,可以发生反应并回收其中的金属Ag(填写金属元素符号),离子方程式是Fe+2Ag+=2Ag+Fe2+.
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:Ag++Cl-=AgCl↓;Fe3++3OH-=Fe(OH)3↓.
(4)经过滤后的废水主要含KNO3,可用来浇灌农田.
分析 甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NO3-,根据两厂中含有的离子组成及性质解答该题.
解答 解:(1)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,
根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl-、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,
由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NO3-,故答案为:K+;Cl-;OH-;
(2)含有的金属离子有K+、Ag+、Fe3+,加入单质Fe,铁可置换出Ag,可以发生反应并回收其中的金属Ag,反应的离子方程式为:Fe+2Ag+=2Ag+Fe2+,
故答案为:Ag;Fe+2Ag+=2Ag+Fe2+;
(3)将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,反应离子方程式为:Ag++Cl-=AgCl↓、Fe3++3OH-=Fe(OH)3↓;
故答案为:Ag++Cl-=AgCl↓、Fe3++3OH-=Fe(OH)3↓;
(4)生成沉淀的离子有Ag+、Fe3+、Cl-、OH-等,经过滤后的废水主要KNO3,可作化肥使用;
故答案为:KNO3.
点评 本题考查较为综合,涉及离子共存以及离子检验等问题,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意判断甲乙厂废水成分的角度以及离子的性质.

练习册系列答案
相关题目
15.下列电离方程式中,正确的是( )
| A. | KOH═K++O2-+H+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═2H++SO42- | D. | Fe2(SO4)3═Fe23++3SO42- |
16.“钴酞菁(直径为1.5×10-9 m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性.下列说法不正确的是( )
| A. | “钴酞菁”分子所形成的分散系具有丁达尔效应 | |
| B. | “钴酞菁”分子既能透过滤纸,也能透过半透膜 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 将磁性物质制成胶体粒子作为药物的载体,可在磁场作用下送到病灶处 |
13.下列叙述中,正确的是( )
| A. | 熵变大于0的反应肯定是自发的 | |
| B. | 焓变小于0的反应肯定是自发的 | |
| C. | 对于同一物质在不同状态时的熵值是:气态>液态>固态 | |
| D. | 自发反应的反应速率肯定很快 |
20.今有下列两个氧化还原反应:①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3 则FeCl3、Cl2、I2的氧化性顺序为( )
| A. | FeCl3>Cl2>I2 | B. | I2>FeCl3>Cl2 | C. | Cl2>FeCl3>I2 | D. | FeCl3>Cl2>I2 |
10.下列各组离子一定能大量共存的是( )
| A. | 在强酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| B. | 强碱性溶液中:NH4+、Al3+、HCO3-、NO3- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、CO32- | |
| D. | 在无色溶液中:K+、H+、Cl-、MnO4- |
15.某化学兴趣小组用如下装置模拟工业制备造纸原料BaSO3,并测定产品纯度.
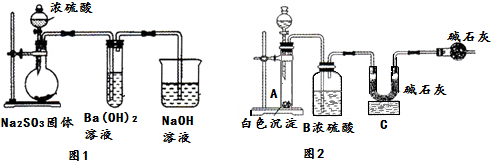
(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.

(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.