题目内容
1.下列化合物,按其晶体的熔点由高到低的顺序排列正确的是( )| A. | CF4 CBr4 CsCl SiO2 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | SiO2 CsCl CBr4 CF4 |
分析 一般来说晶体的熔点原子晶体>离子晶体>金属晶体>分子晶体,相同晶体从影响晶体熔沸点高低的因素分析.
解答 解:CF4、CBr4属于分子晶体,CsCl属于离子晶体,分子晶体相对分子质量越大,熔点越高,所以熔点CF4 小于CBr4; SiO2属于原子晶体,CsCl属于离子晶体,一般来说晶体的熔点原子晶体>离子晶体>金属晶体>分子晶体,所以熔沸点由高到低:SiO2 CsCl CBr4 CF4,
故选:D.
点评 本题考查了晶体熔沸点高低判断,明确不同类型晶体熔沸点规律是解题关键,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
15.某化学兴趣小组用如下装置模拟工业制备造纸原料BaSO3,并测定产品纯度.
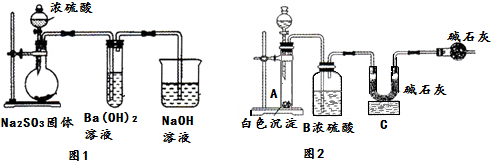
(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.

(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.
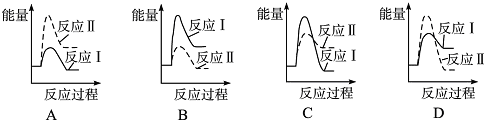
16.可逆反应aA(s)+bB(g)?cC(g)+dD(g),当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是( )

| A. | P1>P2,a+b=c+d | B. | Pl<P2,b=c+d | ||
| C. | T1>T2,正反应放热 | D. | Tl<T2,正反应吸热 |
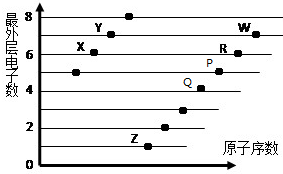 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.