题目内容
10.用系统命名法命名: 2,3-二甲基戊烷.
2,3-二甲基戊烷.
分析 该有机物为烷烃,主链最长碳链含有5个C,编号从右到左,在2、3号C各含有1个甲基.
解答 解: ,该有机物为烷烃,主链最长碳链含有5个C,编号从右到左,在2、3号C各含有1个甲基,该有机物命名为:2,3-二甲基戊烷;
,该有机物为烷烃,主链最长碳链含有5个C,编号从右到左,在2、3号C各含有1个甲基,该有机物命名为:2,3-二甲基戊烷;
故答案为:2,3-二甲基戊烷.
点评 本题主要考查了有机物结构简式的书写、命名及甲烷的取代反应,难度不大,要注意掌握有机物的结构特点是解题的关键.

练习册系列答案
相关题目
20.今有下列两个氧化还原反应:①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3 则FeCl3、Cl2、I2的氧化性顺序为( )
| A. | FeCl3>Cl2>I2 | B. | I2>FeCl3>Cl2 | C. | Cl2>FeCl3>I2 | D. | FeCl3>Cl2>I2 |
15.某化学兴趣小组用如下装置模拟工业制备造纸原料BaSO3,并测定产品纯度.
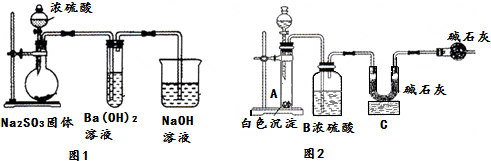
(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.

(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.
2. 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时充入Z,达到新平衡时Z的体积分数增大 |
19.医学家最近合成了一种具有抗癌活性的化合物Depudecin,该物质也曾从真菌里分离出来,其结构简式如下:
下列关于该化合物的说法正确的是( )

下列关于该化合物的说法正确的是( )
| A. | 该化合物的分子式为C12H16O4 | |
| B. | 该化合物属于有机酯类,所以可以发生水解反应 | |
| C. | 该化合物既可以发生消去反应,也可以被催化氧化生成醛 | |
| D. | 1mol该化合物可以和2mol醋酸发生取代反应 |
16.可逆反应aA(s)+bB(g)?cC(g)+dD(g),当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是( )

| A. | P1>P2,a+b=c+d | B. | Pl<P2,b=c+d | ||
| C. | T1>T2,正反应放热 | D. | Tl<T2,正反应吸热 |