题目内容
20.A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻,C与E同主族,A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.请回答相关问题:(1)化合物AE2的结构式S=C=S
(2)化合物D2C2的电子式
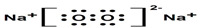
(3)在容积不变的密闭容器中进行如下反应:3F2(g)+B2(g) 2BF3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是AD(填序号).
A.反应物的转化率增大 B.平衡不发生移动
C.F2的质量分数增大 D.正逆反应速率都增大.
分析 根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,据此答题.
解答 解:根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,
(1)化合物AE2为CS2,其结构式为S=C=S,故答案为:S=C=S;
(2)化合物D2C2为Na2O2,Na2O2的电子式为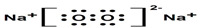 ,故答案为:
,故答案为: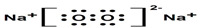 ;
;
(3)在容积不变的密闭容器中进行如下反应:3H2(g)+N2(g)?2NH3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,即相当于将体积减小为原来的一半,根据勒夏特列原理可知,平衡向正反应方向移动,反应物的转化率增大,氢气的质量分数减小,压强增大,正逆反应速率都增大,故选AD.
点评 本题主要考查了电子式、结构式、化学平衡的移动等知识点,中等难度,解题的关键在于根据元素的性质确定元素种类,第(3)小问时注意化学平衡移动原理的灵活运用.

练习册系列答案
 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
10.下列各组离子一定能大量共存的是( )
| A. | 在强酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| B. | 强碱性溶液中:NH4+、Al3+、HCO3-、NO3- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、CO32- | |
| D. | 在无色溶液中:K+、H+、Cl-、MnO4- |
11.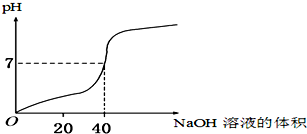 用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
 用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A. | 1.0 mol/L,20 mL | B. | 0.5 mol/L,40 mL | C. | 0.5 mol/L,80 mL | D. | 1.0 mol/L,80 mL |
15.某化学兴趣小组用如下装置模拟工业制备造纸原料BaSO3,并测定产品纯度.
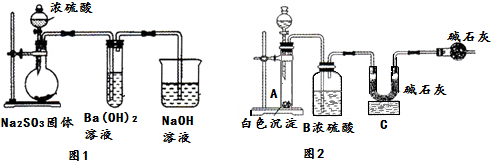
(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.

(1)图1烧瓶中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O.
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有:
①BaSO3②BaSO4.
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入盐酸(可从盐酸、硝酸、NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为$\frac{217m}{64w}$×100%(用含m、w的式子表示).
若最终测得的BaSO3的质量分数偏小,可能的原因是:SO2未被完全吸收
若最终测得的BaSO3的质量分数偏大,可能的原因是:盐酸挥发出HCl被C中碱石灰吸收
(5)形成②的原因可能是装置中残留的氧气使Na2SO3氧化生成Na2SO4,为制备纯净的BaSO3,请设计改进图1装置的实验方案:从烧瓶左边通入氮气排除装置中的空气.
5. 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
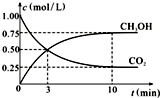
(3)对于第二个反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一恒温恒容密闭容器中充入1molCO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.试回答:0~10min内,氢气的平均反应速率为0.225mol•L-1•mm-1.该反应平衡常数表达式$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大(填“变大”、“减少”或“不变”).该反应的平衡常数不变(填“变大”、“变小”或“不变”).
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(3)对于第二个反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一恒温恒容密闭容器中充入1molCO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.试回答:0~10min内,氢气的平均反应速率为0.225mol•L-1•mm-1.该反应平衡常数表达式$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大(填“变大”、“减少”或“不变”).该反应的平衡常数不变(填“变大”、“变小”或“不变”).
12. 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如表.则该温度下反应的平衡常数K=1.2(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,此时v(正)< v(逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响.
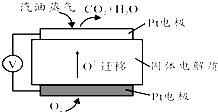
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(6)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
反应b中理论上原子利用率为46%.
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如表.则该温度下反应的平衡常数K=1.2(保留2位有效数字)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(6)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
反应b中理论上原子利用率为46%.
 Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.
Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.