��Ŀ����
7��ij�л�������A����Է�����������150��С��200����������֪����������̼���⡢����������Ϊ7.5��1.125��3��A�������ԣ��Ƿ������е���Ч�ɷ֣����ʵ���Ϊ0.0002mol��A����20.0 mL 0.0100mol/L��������ˮ��Һ���ζ��ﵽ�ζ��յ㣮��1���л�������A����Է���������186���û�����Ļ�ѧʽ������ʽ��C10H18O3��
��2����֪A��ʹ������Ȼ�̼��Һ��ɫ��A������������ԭˮ�ⷴӦ����B��C��B�ܷ���������Ӧ������������ƻ�����������Һ��Ӧ��
��Ϣ��ʾ����һ�������£�ϩ���ɷ�����������ԭˮ�ⷴӦ�������ʻ�������÷�Ӧ�ɱ�ʾΪ��
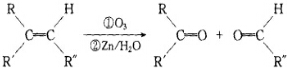
��R R��R��Ϊ�������⣩
���Ϸ�Ӧ��B�Ľ�һ����Ӧ��ͼ��ʾ��
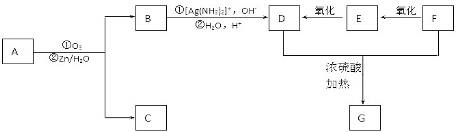
1molD��������̼��������Һ��Ӧ�ɷų�������̼44.8L����״����������D��F��Ũ���������¼��ȣ���������һ����ѧʽ������ʽ��ΪC4H4O4����Ԫ��G���÷�Ӧ�Ļ�ѧ����ʽ��HOOCCOOH+HOCH2CH2OH$��_{��}^{ŨH_{2}SO_{4}}$
 +2H2O����Ӧ������������Ӧ��D��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
+2H2O����Ӧ������������Ӧ��D��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O����3�����ⶨ���л�������Cû��֧����������û��-CH3��д���л�������A�Ľṹ��ʽOHC��CH2��6CH2OH��
���� A�������ԣ����ʵ���Ϊ0.0002mol��A����20.0 mL 0.0100mol/L��������ˮ��Һ���ζ��ﵽ�ζ��յ㣬˵��A����һ���Ȼ�����������̼���⡢����������Ϊ7.5��1.125��3��������Ԫ�ص���������Ϊ$\frac{3}{7.5+1.125+3}$=0.258�������������2����ԭ�ӣ�����Է�������Ϊ$\frac{32}{0.258}$=124����������3����ԭ�ӣ�����Է�������Ϊ$\frac{48}{0.258}$=186���л�������A����Է�����������150��С��200�����Է����к���3����ԭ�ӣ��������⣬������̼ԭ����Ϊ$\frac{7.5��48}{3��12}$=10����ԭ����Ϊ$\frac{1.125��48}{3}$=18������A�ķ���ʽΪC10H18O3��A��ʹ������Ȼ�̼��Һ��ɫ��˵��A����̼̼˫����A������������ԭˮ�ⷴӦ����B��C��B�ܷ���������Ӧ������������ƻ�����������Һ��Ӧ��˵��B�����Ȼ���ȩ����B������D��1molD��������̼��������Һ��Ӧ�ɷų�������̼44.8L����״������˵��D���������Ȼ���F������������D��˵��FΪ����D��F��Ũ���������¼��ȣ���������һ����ѧʽ������ʽ��ΪC4H4O4����Ԫ��G����GӦΪ �����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH���ݴ˴��⣮
�����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH���ݴ˴��⣮
��� �⣺A�������ԣ����ʵ���Ϊ0.0002mol��A����20.0 mL 0.0100mol/L��������ˮ��Һ���ζ��ﵽ�ζ��յ㣬˵��A����һ���Ȼ�����������̼���⡢����������Ϊ7.5��1.125��3��������Ԫ�ص���������Ϊ$\frac{3}{7.5+1.125+3}$=0.258�������������2����ԭ�ӣ�����Է�������Ϊ$\frac{32}{0.258}$=124����������3����ԭ�ӣ�����Է�������Ϊ$\frac{48}{0.258}$=186���л�������A����Է�����������150��С��200�����Է����к���3����ԭ�ӣ��������⣬������̼ԭ����Ϊ$\frac{7.5��48}{3��12}$=10����ԭ����Ϊ$\frac{1.125��48}{3}$=18������A�ķ���ʽΪC10H18O3��A��ʹ������Ȼ�̼��Һ��ɫ��˵��A����̼̼˫����A������������ԭˮ�ⷴӦ����B��C��B�ܷ���������Ӧ������������ƻ�����������Һ��Ӧ��˵��B�����Ȼ���ȩ����B������D��1molD��������̼��������Һ��Ӧ�ɷų�������̼44.8L����״������˵��D���������Ȼ���F������������D��˵��FΪ����D��F��Ũ���������¼��ȣ���������һ����ѧʽ������ʽ��ΪC4H4O4����Ԫ��G����GӦΪ �����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH��
�����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH��
��1����������ķ�����֪��A����Է��������� 186���û�����Ļ�ѧʽ��C10H18O3��
�ʴ�Ϊ��186��C10H18O3��
��2��HOOCCOOH��HOCH2CH2OH��Ũ���������·���������Ӧ���� ����Ӧ�ķ���ʽΪHOOCCOOH+HOCH2CH2OH$��_{��}^{ŨH_{2}SO_{4}}$
����Ӧ�ķ���ʽΪHOOCCOOH+HOCH2CH2OH$��_{��}^{ŨH_{2}SO_{4}}$ +2H2O��HOOCCOOH��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽΪHOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
+2H2O��HOOCCOOH��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽΪHOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
�ʴ�Ϊ��HOOCCOOH+HOCH2CH2OH$��_{��}^{ŨH_{2}SO_{4}}$ +2H2O��������Ӧ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
+2H2O��������Ӧ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
��3����������ķ�����֪��CΪOHC��CH2��6CH2OH���ʴ�Ϊ��OHC��CH2��6CH2OH��
���� ���⿼���л������ʽ��ȷ����ͬ���칹�����д�ȣ���Ŀ�Ѷ��еȣ�����Ԫ�������ȼ��ת����ϵȷ��A�Ľṹ�ǽ���Ĺؼ���

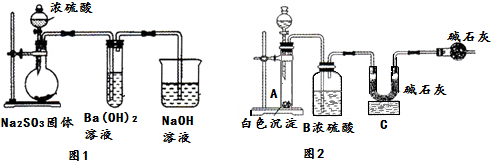
��1��ͼ1��ƿ�з�����Ӧ�Ļ�ѧ����ʽΪNa2SO3+H2SO4��Ũ���TNa2SO4+SO2��+H2O��
��2����ͬѧ�۲쵽ͼ1�Թ��г��ְ�ɫ�������ð�ɫ�������ܺ��У�
��BaSO3��BaSO4��
ʵ��һ��̽����ɫ�����ijɷ�
��3���������ʵ�鷽����
| ʵ�鲽�� | Ԥ����������� |
| ����1����������ɫ�������Թ��У�������������ˮ���μӼ���Ʒ����Һ | ��ɫ�������ܽ⣬��Һ�ʺ�ɫ�� |
| ����2���������Թ��еμ�����ϡ���ᣬ����� | �����������ܽ⣬���Тڣ� |
��4��ȡ��ɫ����wg��ͼ2װ�õ��Թܣ��ڷ�Һ©���м������ᣨ�ɴ����ᡢ���ᡢNaOH��Һ��ѡ��һ�֣���ʵ����Cװ������mg�����ݴ�ʵ�����ݿɼ������ɫ������BaSO3����������Ϊ$\frac{217m}{64w}$��100%���ú�m��w��ʽ�ӱ�ʾ����
�����ղ�õ�BaSO3����������ƫС�����ܵ�ԭ���ǣ�SO2δ����ȫ����
�����ղ�õ�BaSO3����������ƫ���ܵ�ԭ���ǣ�����ӷ���HCl��C�м�ʯ������
��5���γɢڵ�ԭ�������װ���в���������ʹNa2SO3��������Na2SO4��Ϊ�Ʊ�������BaSO3������ƸĽ�ͼ1װ�õ�ʵ�鷽��������ƿ���ͨ�뵪���ų�װ���еĿ�����
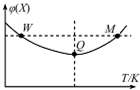 ��2L�����ܱ������г���2mol X��1mol Y������Ӧ��2X��g��+Y��g��?3Z��g������Ӧ���̳��������¶ȣ����X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������
��2L�����ܱ������г���2mol X��1mol Y������Ӧ��2X��g��+Y��g��?3Z��g������Ӧ���̳��������¶ȣ����X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������| A�� | Q��ʱ��Y��ת������� | |
| B�� | �����¶ȣ�ƽ�ⳣ������ | |
| C�� | W��X������Ӧ���ʵ���M��X������Ӧ���� | |
| D�� | ƽ��ʱ����Z���ﵽ��ƽ��ʱZ������������� |
 ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�
ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�I����ҵ������úת��ΪCO��������CO��ˮ������Ӧ��H2ʱ����������ƽ�⣺
CO��g��+H2O��g��?CO2��g��+H2��g��
��1����1L�����ܱ������г���CO��H2O��g����800��ʱ��ò����������������¶��·�Ӧ��ƽ�ⳣ��K=1.2������2λ��Ч���֣�
| t/min | 0 | 1 | 2 | 3 | 4 |
| n��H2O��/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n��CO��/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
����֪CO��g����H2��g����CH3OH��l����ȼ���ȷֱ�Ϊ283kJ•mol-1��286kJ•mol-1��726kJ•mol-1��
��3������CO��H2�ϳ�Һ̬�״����Ȼ�ѧ����ʽΪCO��g��+2H2��g��=CH3OH��l����H=-129kJ•mol-1��
��4�����ݻ�ѧ��Ӧԭ������������ѹǿ���Ʊ��״���Ӧ��Ӱ�죮
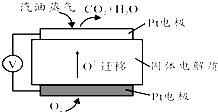
��Ϊ���Ѷ�ʯ�͵Ĺ���������������Ա��úҺ���Ʊ����ͣ������������ȼ�ϵ�أ���ع���ԭ����ͼ��ʾ��һ���缫ͨ����������һ�缫ͨ������������������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2-��
��5�������飨C8H18���������ͣ�д���õ�ع���ʱ�ĸ�����Ӧ����ʽC8H18-50e-+25O2-=8CO2+9H2O��
����úȼ�ղ�����CO2���������ЧӦ����Ҫ����֮һ��
��6����CO2ת�����л������Ч��ʵ��̼ѭ�����磺
a��6CO2+6H2O$\stackrel{����/Ҷ����}{��}$C6H12O6+6O2
b��2CO2+6H2$��_{��}^{����}$C2H5OH+3H2O
c��CO2+CH4$��_{��}^{����}$CH3COOH
d��2CO2+6H2$��_{��}^{����}$CH2=CH2+4H2O
��Ӧb��������ԭ��������Ϊ46%��
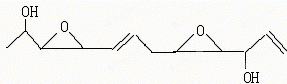
���й��ڸû������˵����ȷ���ǣ�������
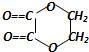
| A�� | �û�����ķ���ʽΪC12H16O4 | |
| B�� | �û����������л����࣬���Կ��Է���ˮ�ⷴӦ | |
| C�� | �û�����ȿ��Է�����ȥ��Ӧ��Ҳ���Ա�����������ȩ | |
| D�� | 1mol�û�������Ժ�2mol���ᷢ��ȡ����Ӧ |
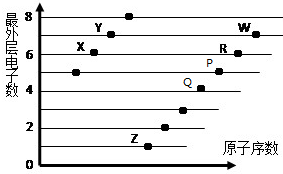 ��ͼ�Dz��ֶ�����Ԫ��ԭ�ӣ�����ĸ��ʾ��������������ԭ�������Ĺ�ϵ��
��ͼ�Dz��ֶ�����Ԫ��ԭ�ӣ�����ĸ��ʾ��������������ԭ�������Ĺ�ϵ��