题目内容
4.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | A与D元素所形成的化合物中只含极性键 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
分析 A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,则E处于IA族,D处于ⅥA族,故E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl,据此解答.
解答 解:A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,则E处于IA族,D处于ⅥA族,故E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl.
A.实验室用MnO2和HCl来制备氯气,工业上电解饱和食盐水制备氯气,故A错误;
B.A与D元素所形成的化合物有H2O、H2O2,前者只含极性键,后者含有极性键、非极性键,故B错误;
C.F所形成的氢化物HCl,酸性强于碳酸,不能说明Cl的非金属性强于C,若HF属于弱酸,硫酸属于强酸,故C错误;
D.可以形成COCl2这种化合物,结构式为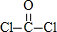 ,故D正确,
,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重于考查学生对所学知识点综合应用能力,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 0.2mol S在空气中充分燃烧,转移电子数为0.6NA | |
| C. | 0.1molCl2与足量的水充分反应,转移电子数为0.1NA | |
| D. | 1.5molNa2O2与足量的二氧化碳充分反应,转移电子数为1.5NA |
15.下列微粒可以大量共存于同一溶液中的是( )
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Ca2+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | C6H5O-、Fe3+、H+、Cl- |
12.下列依据相关实验得出的结论正确的是( )
| 编号 | 实 验 | 结 论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀,说明样品溶液中一定含有SO42- |
| C | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成,表明淀粉没有水解生成葡萄糖 |
| D | 向0.1mol•L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 | 浅红色加深,说明Na2CO3的水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
19.下列有关说法正确的是( )
| A. | Na2CO3和NaOH都能抑制水的电离 | |
| B. | 0.1 mol•L-1Na2CO3溶液加水稀释,CO32-的水解程度增大,溶液pH减小 | |
| C. | 酸碱中和滴定实验中,锥形瓶需用待测液润洗2~3次后,再加入待测液 | |
| D. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n |
16.化学与生活、生产息息相关,下列说法中错误的是( )
| A. | 海鲜中有较多Zn元素,经常食用可提高免疫力 | |
| B. | 聚乳酸可用作手术缝合纱线、缓释药物材料 | |
| C. | 氨冷冻系统可用于禽类加工厂的冷库 | |
| D. | 用浓硫酸处理碱性工业废水 |
13.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列说法不正确的是( )
| A. | 在熔融电解质中,O2-向正极定向移动 | |
| B. | 通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O | |
| C. | 通入空气的一极是正极,电极反应为:O2+4e-═2O2- | |
| D. | 电池的总反应是:2C4H10+13O2═8CO2+10H2O |
14.标准状况下,2.24L HCl气体溶于100g水中,溶液密度为ρ g•mL-1,所得溶液中溶质的物质的量浓度为( )
| A. | 1mol•L-1 | B. | $\frac{100ρ}{103.65}$mol•L-1 | ||
| C. | $\frac{ρ}{103.65}$mol•L-1 | D. | 无法确定 |