题目内容
1.将等物质的量的A、B混合于2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的量为1mol,C的平均反应速率是0.1mol/(L•min).则x的值为( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 5min内D的反应速率===0.1mol/(L•min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算x值.
解答 解:5min内D的反应速率===0.1mol/(L•min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,C的平均反应速率是0.1mol/(L•min),CD反应速率相等,则CD计量数相等为2,故选B.
点评 本题考查化学反应速率及其计量数的关系,侧重考查学生分析计算能力,明确速率与计量数的关系即可解答,知道反应速率基本公式,题目难度不大.

练习册系列答案
相关题目
11.下列各组物质中,含有化学键的类型(离子键、共价键)相同的是( )
| A. | CaCO3和MgCl2 | B. | NH4F和NaF | C. | Na2O2和H2O2 | D. | H2O和SO2 |
9.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | NaOH | C. | O3 | D. | H2S |
16.下列有关粒子半径的叙述正确的是( )
| A. | 电子层结构相同的粒子随核电荷的递增半径逐渐增大 | |
| B. | CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大 | |
| C. | S2-半径小于硫原子半径 | |
| D. | 无法比较K+、Al3+、O2-、Cl-的半径大小 |
6.下列有关浓硫酸和亚硫酸钠混和放出的气体的说法中不正确的是( )
| A. | 它与氧气接触即转变为SO3 | |
| B. | 亚硫酸钙能溶解于它的水溶液中 | |
| C. | 它的密度比空气小,且不易液化 | |
| D. | 它的水溶液是酸性,且能被强氧化剂氧化 |
 .
.


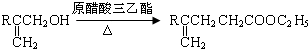
 .
.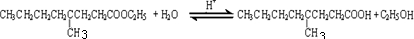 .
.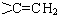 的同分异构体有12种.
的同分异构体有12种.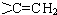 ,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为
,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为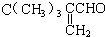 .
.