题目内容
11.下列各组物质中,含有化学键的类型(离子键、共价键)相同的是( )| A. | CaCO3和MgCl2 | B. | NH4F和NaF | C. | Na2O2和H2O2 | D. | H2O和SO2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物、铵盐中都含有离子键,据此分析解答.
解答 解:A.碳酸钙中含有离子键和共价键、氯化镁中只含离子键,所以化学键类型不同,故A错误;
B.氟化铵中含有离子键和共价键、NaF中只含离子键,所以化学键类型不同,故B错误;
C.过氧化钠中含有离子键和共价键、双氧水分子中只含共价键,所以化学键类型不同,故C错误;
D.水分子和二氧化硫分子中都只含共价键,所以化学键类型相同,故D正确;
故选D.
点评 本题考查化学键物判断,侧重考查基本概念,明确物质中存在的化学键即可解答,注意离子键和共价键的区别,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
2.海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
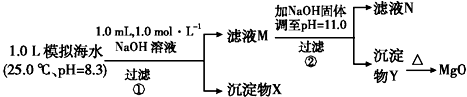
注:溶液中某种离子的浓度小于1.0×10-5 mol•L-1,可认为该离子不存在;
实验过程中,假设溶液体积不变.
KspCaCO3=4.96×10-9 KspMgCO3=6.82×10-6 KspCa(OH)2=4.68×10-6
KspMg(OH)2=5.61×10-12
下列说法不正确的是( )

| 模拟海水中的离 子浓度/mol•L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
实验过程中,假设溶液体积不变.
KspCaCO3=4.96×10-9 KspMgCO3=6.82×10-6 KspCa(OH)2=4.68×10-6
KspMg(OH)2=5.61×10-12
下列说法不正确的是( )
| A. | 沉淀物X为CaCO3、MgCO3 | |
| B. | 滤液M中存在Mg2+,Ca2+ | |
| C. | 滤液N中存在Ca2+,没有Mg2+ | |
| D. | 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为仍Mg(OH)2,没有Ca(OH)2 |
16.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述不正确的是( )
| A. | HAt非常稳定 | |
| B. | AgAt难溶于水 | |
| C. | 砹的非金属性在卤素中是最弱的,At-易被氧化 | |
| D. | 砹难溶于水,易溶于四氯化碳 |
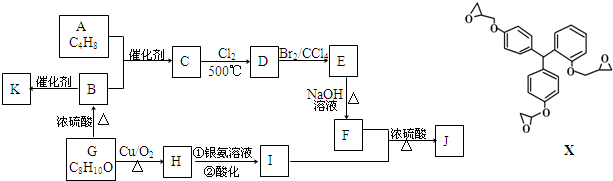
 .
. ;F+I→J
;F+I→J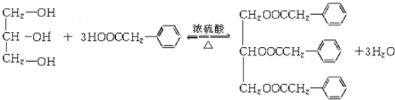 .
. (其中三种).
(其中三种). (X)为卤素原子.
(X)为卤素原子.
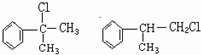 ;
; ;
; +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +NaCl;
+NaCl; 或
或 .
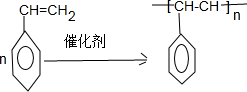
.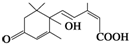 官能团的名称:碳碳双键、羰基、羟基、羧基.
官能团的名称:碳碳双键、羰基、羟基、羧基. 2,3-二甲基戊烷
2,3-二甲基戊烷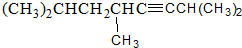 2,5,7-三甲基-3-辛炔
2,5,7-三甲基-3-辛炔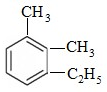
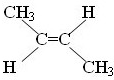 .
.
 CH3COOC2H5+H2O
CH3COOC2H5+H2O