题目内容
16.下列有关粒子半径的叙述正确的是( )| A. | 电子层结构相同的粒子随核电荷的递增半径逐渐增大 | |
| B. | CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大 | |
| C. | S2-半径小于硫原子半径 | |
| D. | 无法比较K+、Al3+、O2-、Cl-的半径大小 |
分析 A.电子层结构相同的粒子随核电荷的递增半径逐渐减小;
B.阴离子半径与阳离子半径比值最大,则需要阴离子半径最大,阳离子半径最小,电子层越多离子半径越大;
C.核电荷数相同,核外电子数越多微粒半径越大;
D.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大.
解答 解:A.电子层结构相同的粒子,随核电荷的递增,原子核对核外电子吸引增大,粒子半径逐渐减小,故A错误;
B.电子层越多离子半径越大、电子层结构相同核电荷数越大离子半径越小,则阳离子半径:Cs+>Ca2+>Na+>Li+,阴离子半径:I->Br->Cl->I-,故LiI的阴阳离子半径之比值最大,故B正确;
C.核电荷数相同,核外电子数越多,微粒半径越大,故S2-半径大于硫原子半径,故C错误;
D.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl->K+>O2->Al3+,故D错误,
故选:B.
点评 本题考查了微粒半径大小的比较,难度不大,明确微粒半径的规律即可解答.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
7.下表是元素周期表的一部分,用化学符号回答下列有关问题:
(1)写出下列元素的符号:①N,⑥Si,⑦S.
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,称为两性氢氧化物的是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(5)在③与④,化学性质较活泼的是Na.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,称为两性氢氧化物的是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(5)在③与④,化学性质较活泼的是Na.
1.将等物质的量的A、B混合于2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的量为1mol,C的平均反应速率是0.1mol/(L•min).则x的值为( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
5.下列说法中,正确的是( )
| A. | △H>0 kJ/mol表示放热反应,△H<0 kJ/mol表示吸热反应 | |
| B. | 热化学方程式中的化学计量数表示物质的量,所以不可以是分数 | |
| C. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| D. | 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的状态 |
6.已知氢气的燃烧热为285.8kJ/mol,CO的燃烧热为282.8kJ/mol;现有氢气和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量710.0kJ,并生成液态水.下列说法正确的是( )
| A. | CO燃烧的热化学方程为2CO(g)+O2(g)=2CO2(g)△H=+282.8 kJ/mol | |
| B. | H2燃烧的热化学方程为2H2(g)+O2(g)=2H2O(g)△H=-571.6 kJ/mol | |
| C. | 燃烧前混合气体中H2的体积分数为40% | |
| D. | 燃烧后的气体与足量的过氧化钠作用可产生1.50 mol氧气 |
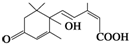 官能团的名称:碳碳双键、羰基、羟基、羧基.
官能团的名称:碳碳双键、羰基、羟基、羧基. 2,3-二甲基戊烷
2,3-二甲基戊烷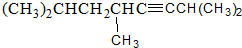 2,5,7-三甲基-3-辛炔
2,5,7-三甲基-3-辛炔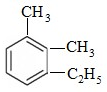
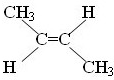 .
. 如图所示装置,c、d两极是石墨电极,回答下列问题:
如图所示装置,c、d两极是石墨电极,回答下列问题: