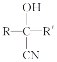
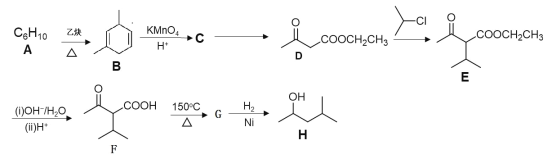
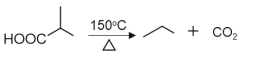
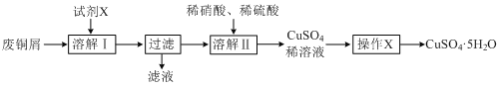
题目内容
【题目】常温下,用一定浓度的盐酸溶液滴定某氨水溶液。滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是
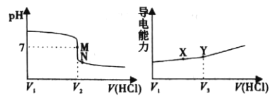
A.M点对应溶液中c(NH4+)=c(Cl-)
B.X→Y溶液导电性增强的主要原因是c(H+)和c(Cl-)增大
C.根据溶液pH和导电能力的变化可判断V2<V3
D.M→N过程中 不变
不变
【答案】B
【解析】
A.常温下,M点溶液呈中性,则溶液中c(OH-)=c(H+),溶液中存在电荷守恒c(NH4+)+c(OH-)=c(H+)+ c(Cl-),所以c(NH4+)=c(Cl-),A正确;
B.X到Y溶液导电性增强主要是溶液中c(H+)、c(NH4+)增大,B错误;
C.NH4Cl是强酸弱碱盐,水解使溶液呈酸性,要使酸碱混合溶液呈中性,则M点NH3·H2O物质的量n(NH3·H2O)大于n(HCl),即氨水有剩余,导电能力中Y点为酸碱恰好完全反应点,Y点n(HCl)=n(NH3·H2O),则V2<V3,C正确;
D.M→N过程中,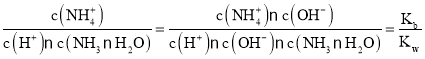 ,物质NH3·H2O的电离平衡常数及水的离子积常数只与温度有关,温度不变,则Kb、Kw不变,因此
,物质NH3·H2O的电离平衡常数及水的离子积常数只与温度有关,温度不变,则Kb、Kw不变,因此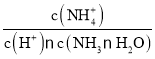 不变,D正确;
不变,D正确;
故错误选项是B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目