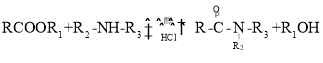题目内容
【题目】自2020年7月1日起,在全国范围内实行轻型汽车国Ⅵ排放标准,该标准对氮氧化物、碳氢化物(HC)、一氧化碳和悬浮粒子等排放物的限制将更为严苛。
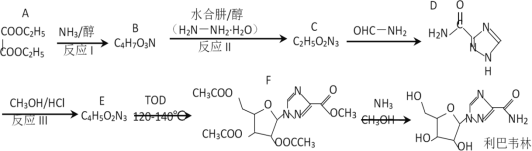
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为___附近,理由是________。推广使用无铅汽油的优点是____________。

(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1
已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+![]() O2(g)=CO(g) △H4
O2(g)=CO(g) △H4
则△H1=_______(用含△H2、△H3、△H4的关系式表示)。
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g) ![]() 3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H
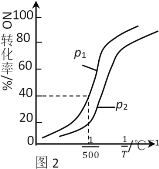
①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H_____0,p1 ____ p2(填“>”或“<”)。
②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=_______。
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
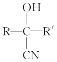
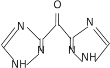
①已知N2H4在水溶液中的一级电离方程式为N2H4H2O![]() +OH-,则
+OH-,则![]() 的电子式为________________。
的电子式为________________。
②已知:Ag+(aq) +2NH3(aq)[Ag(NH3)2]+(aq),其平衡常数表达式为Kf =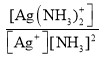 =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:![]() ≈3.16)。
≈3.16)。
【答案】14.7 在空燃比为14.7时,尾气中NOx、HC、CO的含量最低 防止空气污染或减少有毒尾气排放或防止催化剂中毒 2ΔH3-ΔH2-2ΔH4 < < ![]() 或 0.485 p1
或 0.485 p1 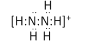 2.06
2.06
【解析】
根据图象中排放尾气含量确定最佳空燃比区域,利用盖斯定律进行反应热的计算,用“定一议二”的方法判断反应吸热或放热,比较压强大小,根据三段式计算平衡常数,结合N2H4·H2O的电离方程式书写![]() 的电子式,根据沉淀溶解平衡常数计算最小浓度。
的电子式,根据沉淀溶解平衡常数计算最小浓度。
(1)由图1可知,在空燃比为14.7时,尾气中NOx、HC、CO的含量最低,则最佳空燃比区域为14.7,推广无铅汽油可防止空气污染或减少有毒尾气排放或防止催化剂中毒,故答案为:14.7;在空燃比为14.7时,尾气中NOx、HC、CO的含量最低;防止空气污染或减少有毒尾气排放或防止催化剂中毒;
(2)根据已知分析可得,反应②×2-①-③×2可得目标反应方程式,则由盖斯定律可得ΔH1=2ΔH3-ΔH2-2ΔH4,故答案为:2ΔH3-ΔH2-2ΔH4;
(3)①由图2分析,其他条件不变时,温度的倒数增大,即温度降低,NO的转化率升高,反应正向进行,则该反应正反应方向为放热反应,即ΔH<0,相同温度时,p1→p2,NO的转化率降低,说明反应逆向进行,增大压强,反应向气体体积减小的方向进行,因此p1<p2,故答案为:<;<;
②在500℃时,NO的转化率为40%,2L密闭容器中充入1molNO、1molNO2和2molNH3,则列三段式有:

根据阿伏加德罗定律可知,恒温恒容时,压强与物质的量成正比,则500℃时该反应的平衡常数为 ,故答案为:
,故答案为:![]() 或0.485p1;
或0.485p1;
(4)①已知N2H4在水溶液中的一级电离方程式为N2H4H2O![]() +OH-,则
+OH-,则![]() 中N与H形成一对共用电子对,N与N形成一对共用电子对,则其电子式为
中N与H形成一对共用电子对,N与N形成一对共用电子对,则其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②已知AgCl(s)![]() Ag+(aq)+Cl-(aq),Ksp(AgCl)=c(Ag+)·c(Cl-)=1.7×10-10,又Ag+(aq)+2NH3(aq)[Ag(NH3)2]+(aq),其平衡常数表达式为
Ag+(aq)+Cl-(aq),Ksp(AgCl)=c(Ag+)·c(Cl-)=1.7×10-10,又Ag+(aq)+2NH3(aq)[Ag(NH3)2]+(aq),其平衡常数表达式为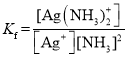 =1.7×107,氨水与AgCl反应的离子反应方程式为2NH3(aq)+AgCl(s)
=1.7×107,氨水与AgCl反应的离子反应方程式为2NH3(aq)+AgCl(s)![]() [Ag(NH3)2]+(aq)+Cl-(aq),该反应的平衡常数为
[Ag(NH3)2]+(aq)+Cl-(aq),该反应的平衡常数为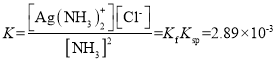 ,根据题意[Cl-]=
,根据题意[Cl-]=![]() =0.1mol/L,[NH3]=c-2[Cl-],则氨水的最小浓度
=0.1mol/L,[NH3]=c-2[Cl-],则氨水的最小浓度![]() ,故答案为:2.06。
,故答案为:2.06。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案