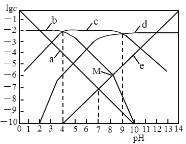
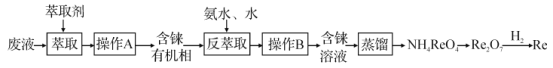
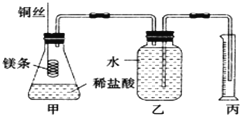
题目内容
【题目】下列离子方程式正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中:HCO![]() +2OH-=CO
+2OH-=CO![]() + H2O
+ H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4 Cl-
D.向氢氧化铁中加入HI溶液:2Fe(OH)3+6H+ +2I—= 2Fe2+ + I2 +6 H2O
【答案】D
【解析】
A.NH4HCO3溶于过量的浓KOH溶液中,![]() 也会与OH-反应生成NH3和H2O,正确的离子方程式为
也会与OH-反应生成NH3和H2O,正确的离子方程式为![]() +HCO
+HCO![]() +2OH-=NH3↑+CO
+2OH-=NH3↑+CO![]() +2H2O,A选项错误;
+2H2O,A选项错误;
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全,正确的离子方程式为Al3++2SO
沉淀完全,正确的离子方程式为Al3++2SO![]() +2Ba2++4OH-=2H2O+2BaSO4↓+
+2Ba2++4OH-=2H2O+2BaSO4↓+![]() ,B选项错误;
,B选项错误;
C.因为氯气过量,所以将FeBr2全部氧化,正确的离子方程式为2Fe2++4Br-+3Cl2=2 Fe3++2Br2+6Cl-,C选项错误;
D.向氢氧化铁中加入HI溶液,氢氧化铁和氢离子发生中和反应生成Fe3+和H2O,Fe3+具有氧化性,且氧化性强于I2,所以Fe3+能够把I-氧化为I2,正确的离子方程式为2Fe(OH)3+6H+ +2I-=2Fe2++I2+6H2O,D选项正确;
答案选D。

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目