��Ŀ����
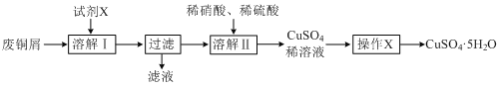
����Ŀ������ʹ�����Ϊ�������õĹؼ��������ǵ�ǰ��ѧ����Ҫ��ע���ȵ����⡣һ�������£���ͼ��ʾװ�ÿ�ʵ���л���ĵ绯ѧ����(��Ŀ������⣬������Ϊ�������л�������)������Ч��=(����Ŀ��������ĵĵ�����/ת�Ƶĵ�������)��100%��������˵��������ǣ� ��
A.�����ƶ�����Ϊ��a��d��e��b
B.d�缫��ӦʽΪC6H6+6H++6e-=C6H12
C.�ô���װ�õĵ���Ч������С��100%����ԭ������dz�Ŀ������⣬����H2����
D.��ͼ�����ݿ�֪����װ�õĵ���Ч��ԼΪ32.1%
���𰸡�D
��������
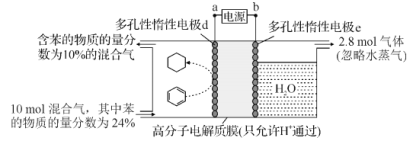
��ͼ��֪����װ��Ϊ���أ����ڵ缫dת��Ϊ�����飬�ù����Ǽ�����̣����ڻ�ԭ��Ӧ����缫dΪ���ص��������缫eΪ���ص�����������aΪ��Դ�ĸ�����bΪ��Դ���������ݴ˷������
A�����ݷ�����dΪ���ص��������缫eΪ���ص�����������aΪ��Դ�ĸ�����bΪ��Դ����������Դ�ڲ������ƶ�����Ϊ��a��d�������е��ӵ��ƶ�����Ϊe��b����A��ȷ��
B��dΪ���ص�������������ԭ��Ӧ��d�缫�ϱ�ת��Ϊ�����飬���ڵõ���Ĺ��̣�������ԭ��Ӧ�����ڴ������ӽ���Ĥ�������������������ƶ�����d�缫��ӦʽΪC6H6+6H++6e-=C6H12����B��ȷ��
C����������Ŀ������⣬�����ܷ��������ӵõ������������ĵ缫��Ӧ������������Ϊ��������C��ȷ��
D����������2.8mol�����壬������Ӧ��Ϊ������OH-�ŵ����ɵ�����������һ��������ʧȥ4�����ӣ���ת�Ƶ��ӵ����ʵ���Ϊ2.8mol��4=11.2mol����������ͨ�����������ĵ�����Ŀ��ȣ��������õ�����ҲΪ11.2mol�������缫��ӦΪ�� C6H6+6H++6e-=C6H12�����뷴Ӧ�ı������ʵ���Ϊ10mol��24%-12mol��10%=1.2mol�������ɻ��������ĵĵ�����Ϊ7.2mol���������������ĵ缫��ӦΪ��2H++2e-=H2���������������ĵĵ�����Ϊ11.2mol-7.2mol=4mol�����װ�õĵ���Ч��Ϊ![]() ��100%��64.3%����D����
��100%��64.3%����D����
��ѡD��

 ��ǰ����ϵ�д�
��ǰ����ϵ�д�