题目内容
全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因.
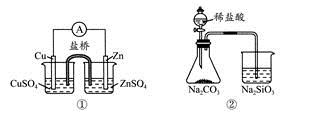
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为______.
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
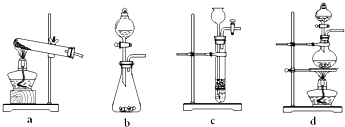
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是______(填答案编号).
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示.
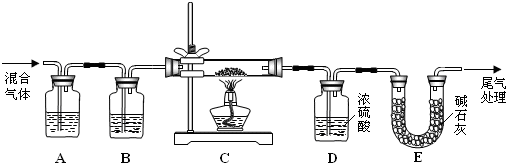
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是______、______(填答案编号).
a.浓硫酸b.澄清的石灰水c.氢氧化钠溶液d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)______.
③E装置的作用是______,上述装置最后尾气处理的方法是______.
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=______.
⑤在本实验中,下列情况会使测定结果n偏大的是______(填答案编号).
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3?nH2O.
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为______.
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
| 浓硫酸 |
| 加热 |

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是______、______(填答案编号).
a.浓硫酸b.澄清的石灰水c.氢氧化钠溶液d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)______.
③E装置的作用是______,上述装置最后尾气处理的方法是______.
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=______.
⑤在本实验中,下列情况会使测定结果n偏大的是______(填答案编号).
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3?nH2O.
(1)钢铁发生吸氧腐蚀,负极是铁失电子生成亚铁离子,电极反应为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)该反应的反应物是液体,反应条件是加热,应选择固液反应且需要加热的装置,所以选d,故答案为:d;
(3)①为得到干燥、纯净的CO气,应先除去混合气体中的二氧化碳,用氢氧化钠吸收即可;混合气体通入氢氧化钠溶液时会带走水蒸气,为除去水蒸气,选用浓硫酸洗气,故答案为:c;a;
②为防止空气对反应的影响,应先除去各装置中的空气,所以要通入混合气体一段时间,
故答案为:通入混合气体一段时间,排除体系中的空气,防止加热时CO发生爆炸;
③E装置防止空气中的二氧化碳和水蒸气进入装置影响实验结果;一氧化碳的处理方法是在最后点燃除去,
故答案为:防止空气中的CO2和H2O进入体系,影响实验结果,点燃;
④由题意知,固体质量减少的量为水和氧的量,浓硫酸吸收的量为水,反应方程式为:
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O 质量减少的量为
18ng (18n+48)g
0.72g 10.00g-8.32g
所以0.72g×(18n+48)g=18ng×( 10.00g-8.32g)
解得n=2,故答案为:2;
⑤a、缺少洗气瓶B会导致装置E增重的质量偏大,所以测定结果n偏大,故a正确;
b、碱石灰吸收的是反应后的二氧化碳,与所测量值无关,所以无影响,故b错误;
c、反应后固体是铁和少量Fe2O3?nH2O,固体减少的质量偏小,导致所测n值偏小,故c错误;
故答案为:a.
(2)该反应的反应物是液体,反应条件是加热,应选择固液反应且需要加热的装置,所以选d,故答案为:d;
(3)①为得到干燥、纯净的CO气,应先除去混合气体中的二氧化碳,用氢氧化钠吸收即可;混合气体通入氢氧化钠溶液时会带走水蒸气,为除去水蒸气,选用浓硫酸洗气,故答案为:c;a;
②为防止空气对反应的影响,应先除去各装置中的空气,所以要通入混合气体一段时间,
故答案为:通入混合气体一段时间,排除体系中的空气,防止加热时CO发生爆炸;
③E装置防止空气中的二氧化碳和水蒸气进入装置影响实验结果;一氧化碳的处理方法是在最后点燃除去,
故答案为:防止空气中的CO2和H2O进入体系,影响实验结果,点燃;
④由题意知,固体质量减少的量为水和氧的量,浓硫酸吸收的量为水,反应方程式为:
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O 质量减少的量为
18ng (18n+48)g
0.72g 10.00g-8.32g
所以0.72g×(18n+48)g=18ng×( 10.00g-8.32g)
解得n=2,故答案为:2;
⑤a、缺少洗气瓶B会导致装置E增重的质量偏大,所以测定结果n偏大,故a正确;
b、碱石灰吸收的是反应后的二氧化碳,与所测量值无关,所以无影响,故b错误;
c、反应后固体是铁和少量Fe2O3?nH2O,固体减少的质量偏小,导致所测n值偏小,故c错误;
故答案为:a.

练习册系列答案
相关题目
 N2O4(g),ΔH<0
N2O4(g),ΔH<0