题目内容
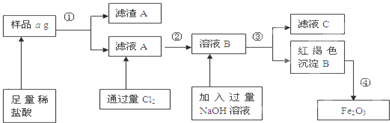
某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
(1)滤液C中溶质含有______(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+______.
(3)对所得Fe2O3固体称量得质量为bg,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)______.

(1)滤液C中溶质含有______(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+______.
(3)对所得Fe2O3固体称量得质量为bg,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)______.
不锈钢(主要成分为Fe)样品中含有铝、铜等,加入足量稀盐酸铁、铝溶解为氯化亚铁和氯化铝溶液,铜不溶解,过滤得到滤渣A为铜,滤液A中含有的溶质成分为FeCl2、AlCl3,通过氯气把氯化亚铁氧化为氯化铁,2FeCl2+Cl2=2FeCl3,得到溶液B中为FeCl3、AlCl3,B溶液中加入过量氢氧化钠溶液反应为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,AlCl3+4NaOH=NaAlO2+3NaCl,过滤得到红褐色氢氧化铁沉淀和滤液C,滤液C中含有的溶质NaAlO2、NaCl、NaOH,红褐色沉淀氢氧化铁加热分解得到氧化铁;
(1)依据上述分析可知滤液C中含有的NaAlO2、NaCl、NaOH;
故答案为:NaAlO2、NaCl、NaOH;
(2)滤液A中含有的溶质成分为FeCl2、AlCl3,验证滤液A中含Fe2+,而不含Fe3+,利用铁离子和亚铁离子的检验方法设计实验步骤分析,实验步骤为:取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色,证明溶液中含有亚铁离子;
故答案为:取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色;
(3)样品质量为ag,所得Fe2O3固体称量得质量为bg,该样品中铁元素质量分数=
×100%=
×100%;
故答案为:
×100%.
(1)依据上述分析可知滤液C中含有的NaAlO2、NaCl、NaOH;
故答案为:NaAlO2、NaCl、NaOH;
(2)滤液A中含有的溶质成分为FeCl2、AlCl3,验证滤液A中含Fe2+,而不含Fe3+,利用铁离子和亚铁离子的检验方法设计实验步骤分析,实验步骤为:取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色,证明溶液中含有亚铁离子;
故答案为:取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色;
(3)样品质量为ag,所得Fe2O3固体称量得质量为bg,该样品中铁元素质量分数=
| ||
| ag |
| 7b |
| 10a |
故答案为:
| 7b |
| 10a |

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0