题目内容
【题目】PbCO3广泛用于陶瓷、油漆和颜料配制等。一种由方铅矿(主要成分为PbS,含少量FeS)和软锰矿(主要成分为MnO2)为原料制备PbCO3的流程如图:
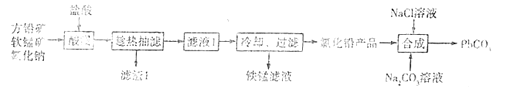
已知:①“酸浸”时PbS反应的方程式为PbS+MnO2+4Cl-+4H+=== PbCl42-+Mn2++S+2H2O。PbCl2易溶于热水,难溶于冷水。在盐酸中因与Cl-形成配合离子PbCl42-而增大PbCl2的溶解度.
②常温下,几种金属离子沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 7.5 | 8.8 |
完全沉淀的pH | 2.3 | 9.7 | 10.4 |
(1)“酸浸”之前需要将方铅矿、软锰矿和氧化钠粉碎并混合均匀,其目的是____。
(2)“趁热抽滤”的目的是___。
(3)铁锰滤液中阳离子主要是Mn2+,还含少量Fe3+、Fe2+。从铁锰滤液中得到较纯锰盐溶液有两种方案:
方案甲:向滤液中加入酸化的双氧水,再加入足量MnCO3粉末,过滤得到锰盐溶液。
方案乙:向滤液中加入稀硫酸酸化,然后加入二氧化锰粉末,充分反应;最后,加氨水调节溶液pH,过滤。
①方案甲中加入MnCO3的目的是_____。
②用离子方程式表示方案乙中“加入二氧化锰”的作用:____。
已知常温下,Ksp[Fe(OH)3]≈1.0×10-38,为了使溶液中c(Fe3+)=1.0×10-5mol·L-1,此时溶液的pH= ____。
③从操作、产品纯度角度考虑,方案____(填“甲”或”乙”)优于另一种方案。
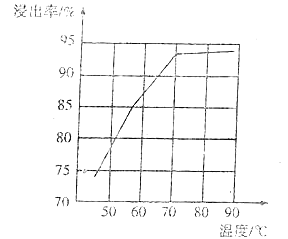
(4)研究工业生产中温度对浸出率的影响如图所示,则生产中浸出过程的最佳温度是___。
(5)向氯化铅(难溶于水)产品中加入氯化钠溶液和碳酸钠溶液,得到碳酸铅产品后,要经过“过滤、洗涤、干燥”等操作,检验碳酸铅是否洗涤干净的操作是____。
【答案】增大接触面积,加快浸出速率,提高原料利用率 避免铅的化合物析出 中和酸,使Fe3+全部转化为Fe(OH)3 MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O 3 甲 70℃ 取最后一次洗涤液于试管中,滴加硝酸酸化,再滴加AgNO3溶液,若无白色沉淀生成,则洗涤干净;若有白色沉淀生成,则未洗涤干净
【解析】
(1)增大固体的接触面可以加快反应速率;
(2) PbCl2易溶于热水,难溶于冷水;
(3)①MnCO3消耗H+,加入MnCO3溶液pH升高,促进铁离子完全水解生成氢氧化铁沉淀;
②根据二氧化锰具有氧化性分析;根据Ksp[Fe(OH)3]≈1.0×10-38计算溶液的pH;
③方案甲不引入新杂质。方案乙需要测定pH;
(4)根据图像、结合能效分析;
(5)碳酸铅表面吸附有氯离子、碳酸根离子等,检验氯离子是否存在,以判断碳酸铅是否洗涤干净。
(1)将方铅矿、软锰矿和氧化钠粉碎并混合均匀,能增大固体与液体的接触面,加快反应速率,提高原料利用率。
(2)PbCl2易溶于热水,难溶于冷水,题意获得铅的化合物溶液,其目的是避免铅的化合物析出,防止铅的化合物损失。
(3)①MnCO3+2H+===Mn2++CO2↑+H2O,MnCO3消耗H+,加入MnCO3溶液pH升高,促进铁离子完全水解生成氢氧化铁。
②二氧化锰其有氧化性,在酸性介质中能把亚铁离子氧化为铁离子,反应的离子方程式是MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O。
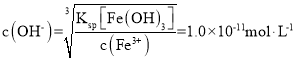 ,c(H+)=1.0×10-3mol·L-1,pH=3。
,c(H+)=1.0×10-3mol·L-1,pH=3。
③方案甲操作简便,不引入新杂质。方案乙需要测定pH,操作较复杂且引入铵盐杂质。方案甲优于方案乙。
(4)观察图像,选择浸出率最高且耗能较低的条件为最佳条件,如70~90℃之间浸出率接近相等,但是,70℃时节能,成本低,所以浸出过程的最佳温度是70℃。
(5)碳酸铅表面吸附有氯离子、碳酸根离子等,检验氯离子是否存在,以判断碳酸铅是否洗涤干净,方法是:取最后一次洗涤液于试管中,滴加硝酸酸化,再滴加AgNO3溶液,若无白色沉淀生成,则洗涤干净,若有白色沉淀生成,则未洗涤干净。

【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+ O2(g)![]() 2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. T1、T2的关系:T1 > T2
B. x= 1.6,y=0.2 ,t<6
C. K1、K2的关系:K2>K1
D. 实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1