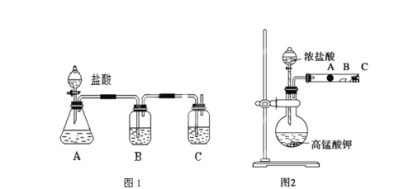
题目内容
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是
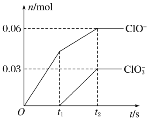
A. 苛性钾溶液中KOH的物质的量是0.09 mol
B. ClO3-的生成是由氯气的量的多少引起的
C. 在酸性条件下ClO-和ClO3-可生成Cl2
D. 反应中转移电子的物质的量是0.21 mol
【答案】D
【解析】
氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,结合m=nM计算氢氧化钾质量。
氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol。
A.通过以上分析知,氢氧化钾的物质的量=0.3mol,选项A错误;
B.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,选项B错误;
C.次氯酸根离子中氯元素是+1价,ClO3-中氯元素是+5价,氯气中氯元素为0价,因此在酸性条件下次氯酸根离子和ClO3-不能发生反应生成氯气,选项C错误;
D.该反应中转移电子的物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,选项D正确;
故选D.

【题目】PbCO3广泛用于陶瓷、油漆和颜料配制等。一种由方铅矿(主要成分为PbS,含少量FeS)和软锰矿(主要成分为MnO2)为原料制备PbCO3的流程如图:
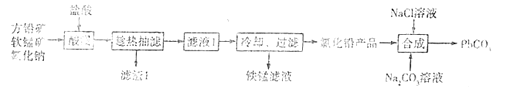
已知:①“酸浸”时PbS反应的方程式为PbS+MnO2+4Cl-+4H+=== PbCl42-+Mn2++S+2H2O。PbCl2易溶于热水,难溶于冷水。在盐酸中因与Cl-形成配合离子PbCl42-而增大PbCl2的溶解度.
②常温下,几种金属离子沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 7.5 | 8.8 |
完全沉淀的pH | 2.3 | 9.7 | 10.4 |
(1)“酸浸”之前需要将方铅矿、软锰矿和氧化钠粉碎并混合均匀,其目的是____。
(2)“趁热抽滤”的目的是___。
(3)铁锰滤液中阳离子主要是Mn2+,还含少量Fe3+、Fe2+。从铁锰滤液中得到较纯锰盐溶液有两种方案:
方案甲:向滤液中加入酸化的双氧水,再加入足量MnCO3粉末,过滤得到锰盐溶液。
方案乙:向滤液中加入稀硫酸酸化,然后加入二氧化锰粉末,充分反应;最后,加氨水调节溶液pH,过滤。
①方案甲中加入MnCO3的目的是_____。
②用离子方程式表示方案乙中“加入二氧化锰”的作用:____。
已知常温下,Ksp[Fe(OH)3]≈1.0×10-38,为了使溶液中c(Fe3+)=1.0×10-5mol·L-1,此时溶液的pH= ____。
③从操作、产品纯度角度考虑,方案____(填“甲”或”乙”)优于另一种方案。
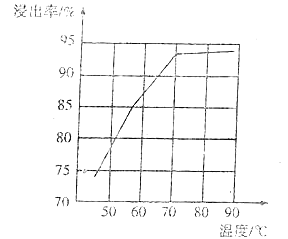
(4)研究工业生产中温度对浸出率的影响如图所示,则生产中浸出过程的最佳温度是___。
(5)向氯化铅(难溶于水)产品中加入氯化钠溶液和碳酸钠溶液,得到碳酸铅产品后,要经过“过滤、洗涤、干燥”等操作,检验碳酸铅是否洗涤干净的操作是____。