题目内容
15.水的电离平衡曲线如右图所示.下列说法正确的是( )
| A. | 图中对应点的温度关系为:a>b>c | |
| B. | 纯水仅升高温度,可从a点变到c点 | |
| C. | 水的电离常数KW数值大小关系为:b=d>c | |
| D. | 在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
分析 A.水的电离是吸热反应,升高温度促进水电离,温度越高水的离子积常数越大;
B.升高温度促进水电离,但溶液中仍然存在c(H+)=c(OH-),呈中性;
C.水的离子积常数只与温度有关,温度越高,水的离子积常数越大;
D.b点对应的温度下,将pH=2的H2SO4中c(H+)=0.01mol/L、pH=10的NaOH溶液中c(OH-)=0.01mol/L,二者等体积混合,氢离子和氢氧根离子恰好反应生成硫酸钠和水.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,温度越高水的离子积常数越大,根据图片知,离子积常数b>c>a,所以温度b>c>a,故A错误;
B.升高温度促进水电离,但溶液中仍然存在c(H+)=c(OH-),呈中性,c点离子积常数大于a,c点c(H+)>c(OH-),溶液呈酸性,升高温度的同时还需要加入酸,故B错误;
C.水的离子积常数只与温度有关,温度越高,水的离子积常数越大,根据图片知,离子积常数b>c>d,a、d是等温线,温度相等,故C错误;
D.b点对应的温度下,将pH=2的H2SO4中c(H+)=0.01mol/L、pH=10的NaOH溶液中c(OH-)=0.01mol/L,二者等体积混合,氢离子和氢氧根离子恰好反应生成硫酸钠和水,硫酸钠是强酸强碱盐,所以其溶液呈中性,故D正确;
故选D.
点评 本题考查水的电离、离子积常数等知识点,明确图中曲线含义是解本题关键,知道离子积常数只与温度有关,与溶液酸碱性无关,题目难度中等,易错选项是B.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
5.已知A、B、C、D四种短周期主族元素,其相关信息如下:
①在元素周期表中的相对位置如下:
②B元素原子的最外层电子数为其核外电子总数的$\frac{2}{7}$,D的单质在空气中燃烧时,生成对环境有严重污染的气体.
请回答下列问题:
(1)D的元素符号为S,B的原子结构示意图为 .
.
(2)C的最高价氧化物对应水化物的化学式为H3PO4.
(3)下列说法中正确的是abc(填字母).
a.A的最高价氧化物对应的水化物在常温下可以和铜反应
b.B的最高价氧化物对应水化物钠盐的水溶液俗称水玻璃
c.常温下,D的最高价氧化物对应水化物的浓溶液可用铁制容器盛放
d.C的离子半径小于D的离子半径
(4)探究法是学习化学的重要方法之一.在下表中列出了对H2DO3各种不同化学性质的推测,根据示例完成下列表格:
①在元素周期表中的相对位置如下:
| A | ||
| B | C | D |
请回答下列问题:
(1)D的元素符号为S,B的原子结构示意图为
 .
.(2)C的最高价氧化物对应水化物的化学式为H3PO4.
(3)下列说法中正确的是abc(填字母).
a.A的最高价氧化物对应的水化物在常温下可以和铜反应
b.B的最高价氧化物对应水化物钠盐的水溶液俗称水玻璃
c.常温下,D的最高价氧化物对应水化物的浓溶液可用铁制容器盛放
d.C的离子半径小于D的离子半径
(4)探究法是学习化学的重要方法之一.在下表中列出了对H2DO3各种不同化学性质的推测,根据示例完成下列表格:
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2DO3+2H2D=3D↓+3H2O |
| ① | 酸性 | |
| ② | H2DO3+Br2+H2O=H2DO4+2HBr |
6.目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成.u夸克带电量为$\frac{2}{3}$e,d夸克带电量-$\frac{1}{3}$e,e为基元电荷.下列论断可能正确的是( )
| A. | 质子由1个u夸克和及1个d夸克组成,中子由1个u夸克和2个d夸克组成 | |
| B. | 质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 | |
| C. | 质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 | |
| D. | 质子由2个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 |
3.200℃时,11.6g由CO2和水蒸气的混合物与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为( )
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 46.4 |
10.某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是( )
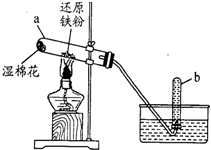

| A. | 甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰 | |
| B. | 乙同学认为试管a中生成的黑色固体可能为四氧化三铁 | |
| C. | 丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应 | |
| D. | 丁同学认为可用盐酸和KSCN溶液来验证产物中的三价铁 |
20.一定量的铁粉和9g硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得18g水,求加入的铁粉质量为( )
| A. | 14g | B. | 42g | C. | 56g | D. | 28g |
7.下列物质中,既含离子键、又含极性共价键的是( )
| A. | NaOH | B. | Na2O | C. | HCl | D. | CaCl2 |
4.设NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 一定条件下,2.3g Na完全与O2反应生成3.6g产物时得到的电子数为0.1NA | |
| B. | 1L 0.1mol醋酸溶液中所含分子数少于0.1NA | |
| C. | 水分子中1mol羟基含有的电子总数为9NA | |
| D. | 1 mol H2O2含有极性共价键键数为NA,含有非极性共价键为键数2NA |
3.某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
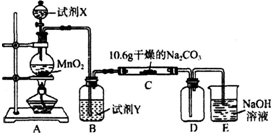
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
(4)己知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.

(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.