题目内容
13.向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述中不正确的是( )| A. | 钠块在乙醇的液面上游动 | B. | 钠块并不熔化 | ||
| C. | 钠块沉在乙醇液面下面 | D. | 钠块表面有气体放出 |
分析 乙醇中含有羟基,能与金属钠反应生成氢气,乙醇的密度比钠小,比在水中反应安静,并不剧烈,钠粒逐渐变小,缓缓产生气泡,据此分析解答.
解答 解:A.钠的密度大于乙醇,所以会沉在乙醇底部,故A错误;
B.钠和乙醇的反应放热很少,不足以将钠融化,故B正确;
C.钠的密度大于乙醇,所以钠块沉在乙醇液面下面,故C正确;
D.钠和乙醇反应2CH3CH2OH+2Na→2CH3CH2ONa+H2↑生成乙醇钠和氢气,所以钠表面有气体放出,故D正确;
故选A.
点评 本题考查了钠与乙醇的反应现象,考查了钠的化学性质及物理性质,注意利用对比法分析钠与水、乙醇的反应现象,明确产生不同现象的原因,题目难度不大.

练习册系列答案
相关题目
3.某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
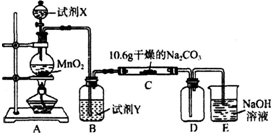
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
(4)己知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.

(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.
4.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是( )
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
8.下列说法正确的是( )
| A. | 常温下稀释溶液0.1mol•L-1CH3COONa溶液,$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| B. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 | |
| D. | 等浓度的NaCl和CH3COONa等体积混合,则混合溶液中:c(Na+)>c(Cl-)>c(OH-)>c(CH3COO-)>c(H+) |
18.下列叙述正确的是( )
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | 只有① | B. | 只有①②⑤ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
5.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 12克金刚石中含有的C-C键数目为为4NA | |
| B. | 1 L 0.1 mol•L-1 NH4Cl溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4L乙烯与丙烯的混合物中含有的分子数目为NA | |
| D. | 常温常压下,Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4NA |
3.如图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法合理的是( )
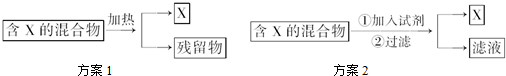

| A. | 可以选用方案1分离碳酸氢钠中含有的氯化铵 | |
| B. | 方案1中残留物可以受热不易挥发 | |
| C. | 方案2中加入的试剂一定能够与除X外的物质发生化学反应 | |
| D. | 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3. |
 写出B的化学式Fe2O3
写出B的化学式Fe2O3