题目内容
20.进行化学实验必须注意安全,下列几种处理事故的方法正确的是( )①酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭
②不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
③镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火
④实验时不慎被玻璃划破手指,引起轻微流血时,用三氯化铁溶液涂抹止血.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
分析 ①酒精易溶于水,应用湿抹布盖灭;
②酸易溶于水;
③干粉的主要成分是碳酸氢钠(NaHCO3),他受热后生成纯碱、水和二氧化碳;
④血液可看作是胶体分散系.
解答 解:①酒精易溶于水,用水不能扑灭,应用湿抹布盖灭,故①错误;
②不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛,以最大程度减小对眼睛的危害,故②正确;
③由点燃的镁条能在二氧化碳中继续燃烧生成碳单质和氧化镁,不能用干粉灭火器灭火,故③错误;
④血液和氢氧化铁胶体都是胶体,带相反电荷的胶体能发生聚沉,故④正确;
故选C.
点评 本题考查化学实验安全及事故的处理,题目难度不大,注意相关实验基本操作知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是( )
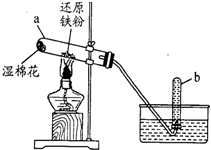

| A. | 甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰 | |
| B. | 乙同学认为试管a中生成的黑色固体可能为四氧化三铁 | |
| C. | 丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应 | |
| D. | 丁同学认为可用盐酸和KSCN溶液来验证产物中的三价铁 |
11.下列说法正确的是( )
| A. | ${\;}_{94}^{214}$Pu位于周期表中第六周期 | |
| B. | ${\;}_{53}^{131}$ I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
15.向a mol BaCl2、AlCl3和FeCl3的混合液A中,逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量n与加入溶液B的体积关系如图所示,下列叙述正确的是( )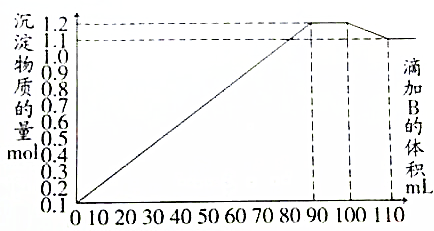

| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |
3.某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
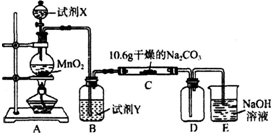
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
(4)己知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.

(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.
10.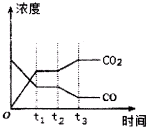 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=0.01mol/(L.min);平衡时,容器中CO的转化率为50%.
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为1.1×10-6mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
7.标准状况下,将VLH2S气体通入a Lb mo l/L的 NaOH 溶液中,下列对所得溶液的描述不正确的是( )
| A. | 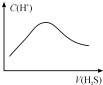 随着 H2S气体的通入,溶液中由水电离出的c(H+)有如图变化关系 | |
| B. | 当$\frac{V}{22.4}$=a b时,所得溶液中存在:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 当$\frac{V}{11.2}$=a b时,所得溶液中存在:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c( H+) | |
| D. | 当$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$时,所得溶液中一定存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
8.下列说法正确的是( )
| A. | 常温下稀释溶液0.1mol•L-1CH3COONa溶液,$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| B. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 | |
| D. | 等浓度的NaCl和CH3COONa等体积混合,则混合溶液中:c(Na+)>c(Cl-)>c(OH-)>c(CH3COO-)>c(H+) |
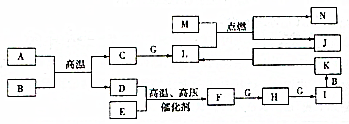 已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:
已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答: