题目内容
13.可用来鉴别己烯、四氯化碳、苯的方法是( )| A. | 酸性高锰酸钾 | B. | 溴水 | C. | 液溴 | D. | NaOH溶液 |
分析 四氯化碳、苯和己烯与溴水混合的现象分别为分层后有机色层在下层、分层后有机色层在上层、溴水褪色;分别与酸性高锰酸钾混合的现象分别为分层后有机层在下层、分层后有机层在上层、紫色褪去,以此来解答.
解答 解:A.己烯使高锰酸钾褪色,四氯化碳与高锰酸钾溶液混合分层有机层在下层,苯与高锰酸钾混合分层后有机层在上层,现象不同,可鉴别,故A选;
B.四氯化碳、苯和己烯与溴水混合的现象分别为分层后有机色层在下层、分层后有机色层在上层、溴水褪色,现象不同,可鉴别,故B选;
C.四氯化碳、苯均与液溴不分层,现象相同,不能鉴别,故C不选;
D.均不与NaOH溶液反应,且苯和己烯与NaOH溶液混合的现象相同,不能鉴别,故D不选;
故选AB.
点评 本题考查有机物的鉴别,为高频考点,把握常见有机物的性质及现象为解答的关键,侧重加成反应及萃取现象的考查,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
3.200℃时,11.6g由CO2和水蒸气的混合物与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为( )
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 46.4 |
4.设NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 一定条件下,2.3g Na完全与O2反应生成3.6g产物时得到的电子数为0.1NA | |
| B. | 1L 0.1mol醋酸溶液中所含分子数少于0.1NA | |
| C. | 水分子中1mol羟基含有的电子总数为9NA | |
| D. | 1 mol H2O2含有极性共价键键数为NA,含有非极性共价键为键数2NA |
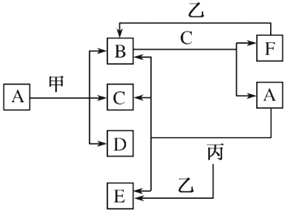
1. 锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
 锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )
锂空气电池(如图)两极分别采用有机电解液和水性电解液,中间以固体电解质膜(只允许Li+通过)隔开,下列说法正确的是( )| A. | 正极一侧为有机电解液 | B. | 放电过程中LiOH在正极生成 | ||
| C. | 放电时Li+从正极区移向负极区 | D. | 专用充电电极可以是铁、铜等金属 |
3.某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
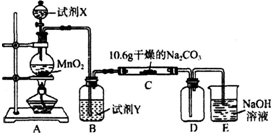
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
(4)己知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.

(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl.
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立;结合步骤2中的②,则假设二成立. |
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH-)-c(H+)=$\frac{3}{2}$c(H2CO3)+$\frac{1}{2}$c(HCO3-)-$\frac{1}{2}$c(CO32-)(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3.
20.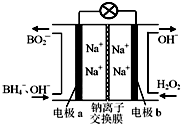 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| C. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| D. | 每消耗3 mol H2O2,转移的电子为3 mol |
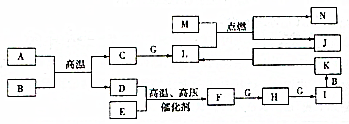 已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:
已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答: