题目内容
【题目】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________(电离度=![]() ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差在本实验的滴定过程中,下列操作会使实验结果偏大的是_________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
【答案】1 1% > 9.9×10-7 溶液由无色恰好变为浅红色,并在半分钟内不褪色 0.075 ab
【解析】
I.(1)等浓度的盐酸和醋酸溶液中pH:HCl<CH3COOH,根据未滴定NaOH溶液时A点和C点pH大小判断盐酸反应曲线;
(2)等浓度的盐酸和醋酸溶液中,盐酸是一元强酸、pH=1,则c(CH3COOH)=c(HCl)=0.1mol/L,结合电离度公式计算电离度;
(3)醋酸、盐酸、NaOH溶液的初始浓度相同,均为0.1000mol/L,盐酸与NaOH恰好反应时pH=7,a=20.00mL;醋酸与NaOH恰好反应时生成醋酸钠,溶液显碱性,要使溶液呈中性,则必须醋酸过量,即b<20.00mL;根据电荷关系计算;
II.(1)④用酚酞作指示剂,如溶液颜色突变且半分钟内不变色,可说明达到滴定终点;
(2)计算消耗标准液体积,求出其平均体积,依据c(待测)= 计算待测液浓度,根据醋酸的浓度计算出该市售白醋的含酸量;
计算待测液浓度,根据醋酸的浓度计算出该市售白醋的含酸量;
(3)根据c(待测)= 分析不当操作对V(标准)的影响,以此判断浓度的误差。
分析不当操作对V(标准)的影响,以此判断浓度的误差。
I.(1)醋酸是弱酸、部分电离,HCl是强酸,完全电离,所以等浓度的盐酸和醋酸的酸性:HCl>CH3COOH,等浓度的盐酸和醋酸溶液中pH:HCl<CH3COOH,由图可知,当V(NaOH)=0时,A点pH=1,C点pH=3,所以图1为滴定盐酸的曲线;
(2)盐酸和醋酸溶液浓度相等,盐酸是一元强酸、pH=1,则c(CH3COOH)=c(HCl)=0.1mol/L,C点pH=3,即0.1mol/L醋酸溶液中c(H+)=0.001mol/L,所以滴定前CH3COOH的电离度=![]() ×100%==1%;
×100%==1%;
(3)醋酸、盐酸、NaOH溶液的初始浓度均为0.1000mol/L,a=20.00mL时盐酸与NaOH恰好反应,醋酸与NaOH恰好反应时生成醋酸钠,溶液显碱性,要使溶液呈中性,则必须醋酸过量,即b<20.00mL,所以a>b;醋酸与NaOH反应的溶液中存在电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-6-10-8)mol/L=9.9×10-7mol/L;
Ⅱ.(1)④选择酚酞作指示剂,用NaOH标准溶液滴定CH3COOH时,开始溶液为无色,随着NaOH的滴入,溶液的酸性逐渐减弱,当滴入最后一滴氢氧化钠溶液时,溶液由无色恰好变成浅红色,且半分钟内不褪色说明滴定达到终点;
(2)四次消耗的标准液的体积中第一次数据误差大,舍去,所以消耗标准液平均体积为15.00mL,根据c(待测)= =0.075mol/L;
=0.075mol/L;
(3)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,导致标准液浓度偏低、消耗标准液体积偏大,依据c(待测)= 分析可知,V(标准)偏大,使测定结果偏大,a符合题意;
分析可知,V(标准)偏大,使测定结果偏大,a符合题意;
b.碱式滴定管尖嘴部分有气泡,滴定后消失,导致消耗标准液体积偏大,依据c(待测)= 分析可知,V(标准)偏大,使测定结果偏大,b符合题意;
分析可知,V(标准)偏大,使测定结果偏大,b符合题意;
c.锥形瓶中加入待测白醋溶液后,再加入少量水,对消耗标准液体积不产生影响,依据c(待测)= 分析可知,对测定结果无影响,c不符合题意;
分析可知,对测定结果无影响,c不符合题意;
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,导致消耗标准液体积偏小,依据c(待测)= 分析可知,V(标准)偏小,使测定结果偏低,d不符合题意;
分析可知,V(标准)偏小,使测定结果偏低,d不符合题意;
e.滴定前平视读数,滴定后俯视读数,导致消耗标准液体积偏小,依据c(待测)= 分析可知,V(标准)偏小,则测定结果偏低,e不符合题意;
分析可知,V(标准)偏小,则测定结果偏低,e不符合题意;
故合理选项是ab。

 名校课堂系列答案
名校课堂系列答案【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
【题目】H2是一种重要的清洁能源。
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。

(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
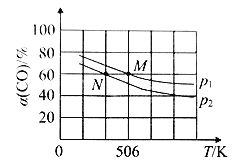
P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。



