题目内容
【题目】H2是一种重要的清洁能源。
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。

(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
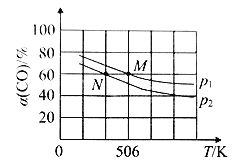
P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。
【答案】12H2O+O2 +28e-=12H2 ↑+14O2- -90.1 B > 正反应为气体分子数减小的反应,加压平衡右移,CO的转化率增大,由图知相同温度时P1下CO的转化率大于P2,所以P1大于P2 AC ![]()
![]()
【解析】
(1)由图可知:在膜II测CH4中的C失去电子被氧化为CO,膜I侧氧气水得到电子,据此分析解答;
(2)根据盖斯定律将两个热化学方程式叠加,可得总反应方程式;根据热化学方程式判断其ΔH、ΔS,并根据体系自由能公式ΔG=ΔH-TΔS<0反应能自发进行判断;
(3)根据压强对化学平衡的影响分析判断;
(4)①反应是在恒容的密闭容器内进行,根据该反应是气体体积减小的放热反应,若反应达到平衡,则任何一组分的物质的量、浓度及含量不变,平均相对分子质量不变,据此分析;
②根据加入各种物质的物质的量及平衡分压的含义、化学平衡常数的定义分析判断;
③根据化学反应速率的定义,用单位时间内分压的变化表示,可得H2的反应速率。
(1)由图可知:在膜II测CH4中的C失去电子被氧化为CO,膜I侧氧气、水得到电子,每1molO2反应,得到4个电子,在膜I侧发生的电极反应为:①O2+4e-=2O2-,②H2O+2e-=H2+O2-↑,假设O2为1,则N2为4,由于在空气中N2与O2的物质的量之比按4:1,反应后膜I侧所得![]() =3,则反应后得到H2为12,即有12molH2O发生反应产生H2,所以①+12×②可得膜I的总反应式:12H2O+O2 +28e-=12H2 ↑+14O2-;
=3,则反应后得到H2为12,即有12molH2O发生反应产生H2,所以①+12×②可得膜I的总反应式:12H2O+O2 +28e-=12H2 ↑+14O2-;
(2) ①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,①+②,整理可得H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ/mol;根据热化学方程式可知:该反应的正反应是气体体积减小的放热反应,ΔH<0,ΔS<0,根据体系的自由能公式ΔG=ΔH-TΔS,若反应能自发进行,则ΔG<0,所以该反应自发进行的条件是低温可自发,选项B符合题意;
CH3OH(g) ΔH1=-90.1kJ/mol;根据热化学方程式可知:该反应的正反应是气体体积减小的放热反应,ΔH<0,ΔS<0,根据体系的自由能公式ΔG=ΔH-TΔS,若反应能自发进行,则ΔG<0,所以该反应自发进行的条件是低温可自发,选项B符合题意;
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的正反应是气体体积减小的反应,在其它条件不变时,增大压强,化学平衡正向移动,CO的平衡转化率增大,根据图示可知CO的转化率P1>P2,所以压强:P1>P2,
CH3OH(g)的正反应是气体体积减小的反应,在其它条件不变时,增大压强,化学平衡正向移动,CO的平衡转化率增大,根据图示可知CO的转化率P1>P2,所以压强:P1>P2,
(4)①A.反应是在恒容的密闭容器内进行,由于该反应是气体体积减小的反应,若反应达到平衡,则容器内气体的压强保持不变,A正确;
B.在任何时刻都存在:v正(H2)=2v正(CH3OH),若反应达到平衡v正(CH3OH)=v逆(CH3OH),则v正(H2)=2v逆(CH3OH),现在2v正(H2)=v逆(CH3OH),说明反应未处于平衡状态,B错误;
C.由于该反应反应前后气体分子数不相等,若混合气体的相对分子质量保持不变,说明气体的物质的量不变,反应达到平衡状态,C正确;
D.由于反应混合物都是气体,在任何状态下气体的质量不变,容器的容积不变,因此任何条件下,混合气体的密度都保持不变,故不能据此判断反应是否处于平衡状态,D错误;
故合理选项是AC;
② 2H2(g) +CO(g)![]() CH3OH(g)
CH3OH(g)
n始(mol) 4 2 0
n10(mol) 2 1 1
n平(mol)2 1 1
由于反应开始时气体的物质的量是6mol,总压强为P0,则平衡时H2占分压为![]() ,CO占分压为
,CO占分压为![]() ,CH
,CH![]() ,带入平衡常数表达式Kp=
,带入平衡常数表达式Kp=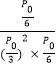 =
=![]() (kPa)-2;
(kPa)-2;
③反应开始时H2占的分压为![]() ,10分钟时占分压为
,10分钟时占分压为![]() ,减少了
,减少了![]() ,所以V(H2)=
,所以V(H2)=![]() =
=![]() Pa/min。
Pa/min。

 备战中考寒假系列答案
备战中考寒假系列答案