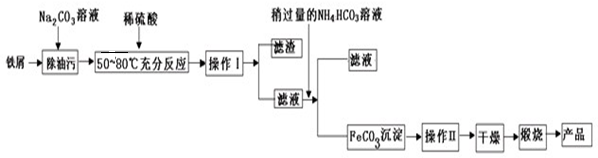
题目内容
13.0.4mol/L的NaOH溶液和0.2mol/L的NaOH溶液(混合前后溶液体积变化忽略不计),求下列两种情况混合后溶液的物质的量浓度.(1)等体积混合;
(2)等质量混合.
分析 (1)设体积为xL,结合c=$\frac{n}{V}$计算;
(2)设质量为m,结合V=$\frac{m}{ρ}$、c=$\frac{n}{V}$计算.
解答 解:(1)设体积为xL,等体积混合,则c=$\frac{n}{V}$=$\frac{x×0.4+x×0.2}{2x}$=0.3mol/L,
答:等体积混合的物质的量浓度为0.3mol/L;
(2)设质量为m,由V=$\frac{m}{ρ}$、c=$\frac{n}{V}$可知,溶液的密度未知,不能计算其体积,则不能计算溶液的物质的量浓度,
答:等质量混合缺少溶液密度不能计算.
点评 本题考查物质的量浓度的计算,为高频考点,把握浓度、物质的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
4.下列物质中含原子总数最多的是( )
| A. | 0.5mol NH3 | B. | 9.03×1023个HCl分子 | ||
| C. | 8g CH4 | D. | 44.8L氧气(标准状况下) |
3.如图1为某加碘盐标签的一部分.

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液.
步骤2:取一支50mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
(1)第一次读数为24.00mL.
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算,此碘盐碘元素的含量为$\frac{508000b}{a}$mgmg•kg-1(用含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏低的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液.
步骤2:取一支50mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.98 | 23.98 |
| 3 | 0 | 24.02 | 24.02 |
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算,此碘盐碘元素的含量为$\frac{508000b}{a}$mgmg•kg-1(用含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏低的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)