题目内容
【题目】制备乙酸乙酯,乙酸正丁酯是中学化学实验中的两个重要有机实验
①乙酸乙酯的制备
②乙酸丁酯![]() 的制备
的制备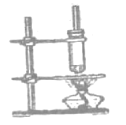
完成下列填空:
(1)制乙酸乙酯的化学方程式___________。
(2)制乙酸乙酯时,通常加入过量的乙醇,原因是________,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是________;浓硫酸用量又不能过多,原因是_______________。
(3)试管②中的溶液是________,其作用是________________。
(4)制备乙酸丁酯的过程中,直玻璃管的作用是________,试管不与石棉网直接接触的原因是_____。
(5)在乙酸丁酯制备中,下列方法可提高1-丁醇的利用率的是________(填序号)。
A.使用催化剂 B.加过量乙酸 C.不断移去产物 D.缩短反应时间
(6)两种酯的提纯过程中都需用到的关键仪器是________,在操作时要充分振荡、静置,待液体分层后先将水溶液放出,最后将所制得的酯从该仪器的________(填序号)
A.上口倒出 B.下部流出 C.都可以
【答案】![]() 增大反应物的浓度,使平衡正向移动,提高乙酸的转化率;; 浓硫酸能吸收反应生成的水,使平衡正向移动,提高酯的产率 浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率 饱和碳酸钠溶液 中和乙酸、吸收乙醇减少乙酸乙酯在水中的溶解 冷凝回流 防止加热温度过高,有机物碳化分解 BC 分液漏斗 A
增大反应物的浓度,使平衡正向移动,提高乙酸的转化率;; 浓硫酸能吸收反应生成的水,使平衡正向移动,提高酯的产率 浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率 饱和碳酸钠溶液 中和乙酸、吸收乙醇减少乙酸乙酯在水中的溶解 冷凝回流 防止加热温度过高,有机物碳化分解 BC 分液漏斗 A
【解析】
(1)实验室用乙醇和乙酸在浓硫酸加热的条件下制乙酸乙酯,化学方程式为![]() 。
。
答案为:![]() ;
;
(2)酯化反应属于可逆反应,加入过量的乙醇,相当于增加反应物浓度,可以让平衡生成酯的方向移动,提高酯的产率;在酯化反应中,浓硫酸的作用是催化剂和吸水剂;理论上"加入数滴浓硫酸即能起催化作用,但实际用量多于此量",原因是:利用浓硫酸能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;“浓硫酸用量又不能过多”,原因是:浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
答案为:增大反应物的浓度,使平衡正向移动,提高乙酸的转化率;浓硫酸能吸收反应生成的水,使平衡正向移动,提高酯的产率;浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
(3)由于乙酸和乙醇具有挥发性,所以制得的乙酸乙酯中常混有少量挥发出的乙酸和乙醇,将产物通到饱和碳酸钠溶液的液面上,饱和碳酸钠溶液的作用是:中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解;
答案为:饱和碳酸钠溶液;中和乙酸、吸收乙醇减少乙酸乙酯在水中的溶解;
(4)乙酸、丁醇加热易挥发,为减少原料的损失,直玻璃管对蒸汽进行冷凝,重新流回反应器内。试管与石棉网直接接触受热温度高,容易使有机物分解碳化。
故答案为:冷凝、回流;防止加热温度过高,有机物碳化分解。
(5)提高1丁醇的利用率,可使平衡向生成酯的方向移动。
A. 使用催化剂,缩短反应时间,平衡不移动,故A错误;
B. 加过量乙酸,平衡向生成酯的方向移动,1丁醇的利用率增大,故B正确;
C. 不断移去产物,平衡向生成酯的方向移动,1丁醇的利用率增大,故C正确;
D. 缩短反应时间,反应未达平衡,1丁醇的利用率降低,故D错误。
答案选BC。
(6)分离互不相溶的液体通常分液的方法,分液利用的仪器主要是分液漏斗,使用时注意下层液从分液漏斗管放出,上层液从分液漏斗上口倒出,酯的密度比水小,应从分液漏斗上口倒出。
故答案为:分液漏斗;A。

【题目】下表是元素周期表的一部分。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ① | |||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ② | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素⑩的氢化物的电子式为___,此氢化物的还原性比元素⑨的氢化物__(强或弱),请用一个化学方程式证明这一事实___。
(2)分别写出⑧⑨⑩最高价氧化物对应的水化物的化学式___,并比较其酸性的强弱__
(3)能生成两性氢氧化物的元素是___,其最高价氧化物的水化物电离方程式为__。