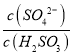题目内容
【题目】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图a所示。在通常状况下,金刚石和石墨中,__________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__________。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式__________________________________________。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g) ![]() CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
则:2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l) △H=___________________。
CH3CH2OH(g)+3H2O(l) △H=___________________。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对上述流程的分析,下列说法正确的是_________。

A.该流程至少包含4种形式的能量转化
B.装置X中阴极反应为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图b为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

① E为该燃料电池的___________极(填“正”或“负”)。F电极上的电极反应式为___________。
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因__________________________。
【答案】 石墨 393.5kJ/mol CO2+8e-+6H2O=CH4+8OH- -305.7 kJ/mol A D 负 ClO-+2e-+H2O=Cl-+2OH- Mg+2H2O=Mg(OH)2+H2
【解析】试题分析:(1)能量越低越稳定;石墨的燃烧热是1mol石墨完全燃烧生成二氧化碳放出的热量;(2)采用电化学法可将二氧化碳转化为甲烷,二氧化碳在正极发生还原反应生成甲烷;(3)①根据盖斯定律计算2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l)的焓变;②根据流程图分析;(4)“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极,镁失去电子生成Mg(OH)2,正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-,以此解答该题;镁与水能反应,所以镁燃料电池负极容易发生自腐蚀。
CH3CH2OH(g)+3H2O(l)的焓变;②根据流程图分析;(4)“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极,镁失去电子生成Mg(OH)2,正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-,以此解答该题;镁与水能反应,所以镁燃料电池负极容易发生自腐蚀。
解析:根据图示可知,相同物质的量的金刚石、石墨燃烧,金刚石放热多,所以金刚石的能量大于石墨,金刚石和石墨中,石墨更稳定;石墨的燃烧热是1mol石墨完全燃烧生成二氧化碳放出的热量,根据图示,1mol石墨完全燃烧生成二氧化碳放出(110.5+283.0)=393.5 kJ,所以石墨的燃烧热是393.5kJ/mol;(2)采用电化学法可将二氧化碳转化为甲烷,二氧化碳在正极得电子发生还原反应生成甲烷,该转化的电极反应式是CO2+8e-+6H2O=CH4+8OH-;
(3) ①H2O(l)=H2O(g) △H=+44kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
③2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
根据盖斯定律③-①![]() -②
-②![]() 得2CO2(g)+6H2(g)
得2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l)△H= -305.7 kJ/mol;②流程图中包括:光能→电能、电能→化学能,热能→化学能,化学能→化学能,热能→动能,故A正确;根据流程图,X是电解水装置,电解水阴极反应式为2H2O+2e-=2OH-+H2↑,故B错误;合成塔中的反应方程式为: 6H2+2CO2=CH3CH2OH+3H2O ,不是化合反应,故C错误;产物是乙醇和水,无污染,故D正确;(4)“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极,所以E为该燃料电池的负极;F是正极,正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-;镁与水能反应,所以镁燃料电池负极容易发生自腐蚀,反应方程式是Mg+2H2O=Mg(OH)2+H2。
CH3CH2OH(g)+3H2O(l)△H= -305.7 kJ/mol;②流程图中包括:光能→电能、电能→化学能,热能→化学能,化学能→化学能,热能→动能,故A正确;根据流程图,X是电解水装置,电解水阴极反应式为2H2O+2e-=2OH-+H2↑,故B错误;合成塔中的反应方程式为: 6H2+2CO2=CH3CH2OH+3H2O ,不是化合反应,故C错误;产物是乙醇和水,无污染,故D正确;(4)“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极,所以E为该燃料电池的负极;F是正极,正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-;镁与水能反应,所以镁燃料电池负极容易发生自腐蚀,反应方程式是Mg+2H2O=Mg(OH)2+H2。

【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂:

对实验现象的“解释或结论”正确的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 氧化性:SO32-<I- |
B | b中无现象,加硫酸后产生淡黄色沉淀 | 硫酸将S2-氧化为硫单质 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | 亚硫酸钠溶液中存在水解平衡 |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. A B. B C. C D. D
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。