题目内容
【题目】下列反应属于非氧化还原反应的是
A. 2Na + Cl2 === 2NaCl B. MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
C. 2KI+Cl2===2KCl+I2 D. MgO+2HCl===MgCl2+H2O
【答案】D
【解析】
反应中有化合价变化的反应为氧化还原反应,没有化合价变化的反应为非氧化还原反应,根据反应中是否存在化合价变化进行判断。
A. 2Na + Cl2 === 2NaCl为化合反应,化合价发生了变化,是氧化还原反应,故A不选;
B. MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O,存在化合价变化,属于氧化还原反应,故B不选;
MnCl2 + Cl2↑ + 2H2O,存在化合价变化,属于氧化还原反应,故B不选;
C. 2KI+Cl2===2KCl+I2为置换反应,存在化合价变化,属于氧化还原反应,故C不选;
D. MgO+2HCl===MgCl2+H2O为复分解反应,不存在化合价变化,属于非氧化还原反应,故D选。
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
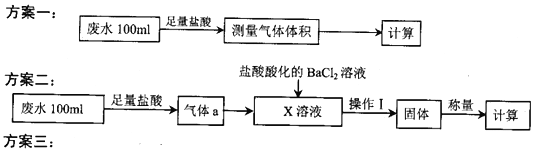
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
(1)利用右图所示的装置完成方案一
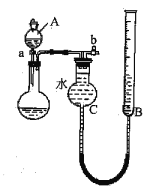
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
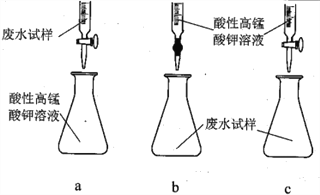
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。




