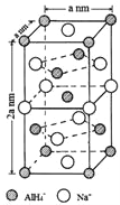
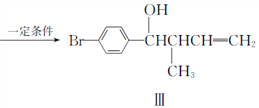
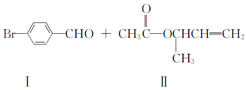题目内容
【题目】在标准状况下①13.44 L CH4②6.02×1023个HCl分子③27.2 g H2S ④0.4 mol NH3,下列对这四种气体的关系从大到小表达错误的是
A. 体积②>③>①>④ B. 质量②>③>④>①
C. 密度②>③>④>① D. 氢原子个数①>③>④>②
【答案】B
【解析】
①n(CH4)=13.44L÷22.4L/mol=0.6mol;
②n(HCl)=![]() ;
;
③n(H2S)=27.2g÷34g/mol=0.8mol;
④n(NH3)=0.4mol。
A.在相同的温度和压强下,气体的物质的量越大,气体的体积就越大。体积:②>③>①>④,A正确;
B.各种气体的质量分别是:①0.6mol×16g/mol=9.6g;②1mol×36.5g/mol=36.5g;③0.8mol×34g/mol=27.2g;④0.4mol×17g/mol=6.8g。质量:②>③>①>④,B错误;
C.在相同的外界条件下,气体的相对分子质量越大,气体的密度就越大。相对分子质量:CH4:16;HCl:36.5;H2S:34;NH3:17,所以密度:②>③>④>①,C正确;
D.各种气体中H原子的物质的量分别是:①2.4mol,②1.0mol,③1.6mol,④1.2mol。因此各种气体的氢原子数关系是:①>③>④>②,D正确。
答案选B。

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
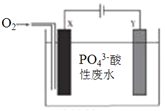
启东小题作业本系列答案【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
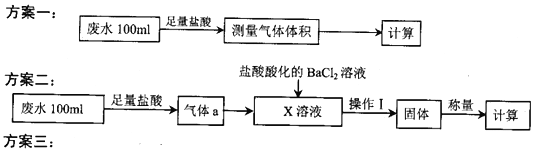
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
(1)利用右图所示的装置完成方案一
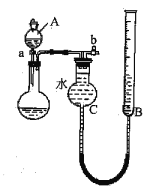
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
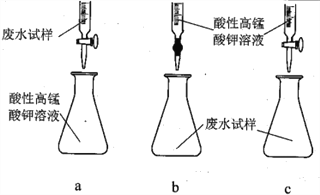
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。

实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。