题目内容
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
【答案】 第三周期,ⅦA族 ac Si(s)+2C12(g)=SiCl4(1) △H=-687kJ/mol 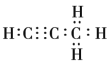 Mg2C3+4H2O=2Mg(OH)2+C3H4↑
Mg2C3+4H2O=2Mg(OH)2+C3H4↑
【解析】(1)根据图表可知,Z是17号氯元素,位于周期表的第三周期,ⅦA族;正确答案:第三周期,ⅦA族。
(2)由元素周期律,非金属元素的单质与氢气越容易化合,氢化物越稳定,非金属性越强,而得电子的数目多少不能作为比较非金属性强弱的依据;活泼的非金属单质能够置换不活泼的非金属单质,可以比较非金属的强弱;氯气可以置换硫,氯化氢比硫化氢稳定,正确选项为ac。
(3)X为硅元素,Z为氯元素,两元素的单质反应生成四氯化硅;已知该化合物的熔、沸点分别为-69℃和58℃,所以四氯化硅为液态,该反应的热化学方程式为:Si(s)+2C12(g)=SiCl4(1) △H=-687kJ/mol ;正确答案:Si(s)+2C12(g)=SiCl4(1) △H=-687kJ/mol。
(4)设该烃分子式为CXHY,烃分子中碳氢质量比为9:1,即12x:y=9:1, x:y=3:4;即分子式为C3H4,该物质为丙炔,电子式为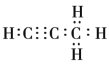 ;正确答案:
;正确答案: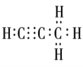 。
。
(5)根据1mol碳与镁形成的化合物Q与4mol水反应,生成2molMg(OH)2和1mol烃条件,遵循原子守恒规律,可知化合物Q的化学式为Mg2C3,反应的方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑;正确答案:Mg2C3+4H2O=2Mg(OH)2+C3H4↑。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。

实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。